2021-2022學年吉林省長春外國語學校高三(上)期初化學試卷
發布:2024/11/22 8:0:31
一、選擇題:本題共7小題,每小題6分,共42分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.中華傳統文化中蘊含著許多化學知識。下列詩句分析錯誤的是( )
A.劉禹錫詩句“千淘萬漉雖辛苦,吹盡狂沙始到金”說明金的化學性質穩定,在自然界中常以單質形態存在 B.中國古代煉丹家制硫酸時用“煉石膽(膽礬)取其精華”,在制硫酸過程中,涉及分解反應 C.《本草綱目》中收載“燒酒”篇:“自元時始創其法,用濃酒和糟入甑,蒸令氣上其清如水,味極濃烈,蓋酒露也。”這里所用的“法”是蒸餾 D.《抱樸子》中“丹砂燒之成水銀,積變又還成丹砂”兩個反應互為可逆反應 組卷:43引用:2難度:0.6 -
2.設為NA阿伏加德羅常數的值,下列敘述中正確的是( )
A.0.1mol CnH2n+2中含有的碳碳單鍵數為0.1n NA B.13g C2H2和苯蒸氣的混合氣體中所含的碳原子數為NA C.標準狀況下,2.24L四氯化碳中所含分子數為0.1NA D.1mol 羥基所含電子數為10NA 組卷:6引用:3難度:0.5 -
3.下列解釋實驗現象的離子方程式不正確的是( )
A.新制氯水中滴加NaOH溶液后,黃綠色褪去:Cl2+2OH-═Cl-+ClO-+H2O B.向Na2CO3溶液中滴加酚酞溶液,溶液變紅:CO32-+H2O?HCO3-+OH- C.向Mg(OH)2懸濁液中滴加FeCl3溶液,生成紅褐色沉淀:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ D.向Na2S2O3溶液中加入稀硫酸,溶液渾濁:2S2O32-+4H+═SO42-+3S↓+2H2O 組卷:32引用:1難度:0.5 -
4.Na2S2O3是重要的化工原料,用途很廣,其還原性較強,在溶液中易被Cl2氧化成SO42-,常用作脫氯劑,主要用于治療氰化物中毒.工業上可利用反應Na2CO3+2Na2S+4SO2═3Na2S2O3+CO2制取Na2S2O3,下列說法正確的是( )
A.每吸收4molSO2,放出22.4LCO2 B.每生成1molNa2S2O3,轉移NA個電子 C.氧化產物與還原產物的質量之比為2:1 D.還原性強弱:S2->S2O32->Cl- 組卷:181引用:3難度:0.7
二、填空題:本題共4題,共58分。
-
11.某硫酸廠產生的燒渣(主要含Fe2O3、FeO及少量SiO2)可用于制備FeSO4?7H2O和還原鐵粉,其流程如圖。
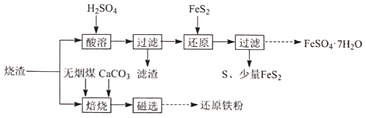
(1)“酸溶”前需粉碎燒渣,其目的是、。
(2)“濾渣”的主要成分是(填化學式)。
(3)“還原”時,FeS2被氧化為SO42-的離子方程式是
(4)“培燒”時,燒渣、無煙煤、CaCO3的投料質量比為100:40:10.溫度控制在100℃溫度對焙燒爐氣含量的影響變化如圖1所示)。添加CaCO3的目的是①脫除Si等;②。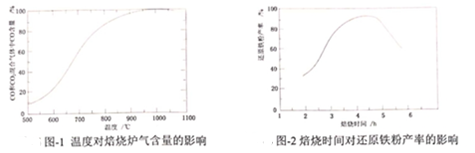
(5)“焙燒”在半封閉裝置中進行,投料層表面蓋有適當厚度的煤層,“焙燒”時間控制在4~5小時(培燒時間對還原鐵粉產率的影響如圖2所示),超過5小時后還原鐵粉產率降低的原因是。組卷:14引用:2難度:0.4 -
12.硼、碳、氮、磷、硫等元素形成的單質和化合物在生活、生產中有重要的用途。
(1)下列氮原子的電子排布圖表示的狀態中,能量由低到高的順序是(填字母)。
A.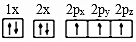
B.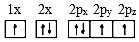
C.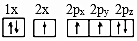
D.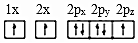
(2)氫、硼、碳、硫四元素的電負性由大到小的順序為。
(3)(CN)2中鍵與鍵之間的夾角為180°,并有對稱性,分子中每個原子的最外層均滿足8電子穩定結構,其結構式為。其σ鍵分別為型σ鍵。
(4)直鏈多磷酸根陰離子是由兩個或兩個以上磷氧四面體通過共用頂角氧原子連接起來的,其結構如圖1所示。則由n個磷氧四面體形成的這類磷酸根離子的通式為。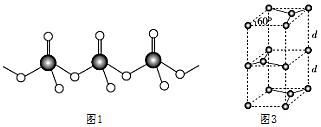
(5)碳酸鹽中的陽離子不同,熱分解溫度就不同。表為四種碳酸鹽的熱分解溫度和對應金屬陽離子的半徑。隨著金屬陽離子半徑的增大,碳酸鹽的熱分解溫度逐漸升高,原因是。
(6)氮化硼(BN)晶體有多種相結構.六方相氮化硼是通常存在的穩定相,可作高溫潤滑劑。立方相氮化硼是超硬材料,有優異的耐磨性 (晶體結構如圖2)。碳酸鹽 MgCO3 CaCO3 SrCO3 BaCO3 熱分解溫度/℃ 402 900 1172 1360 金屬陽離子半徑/pm 66 99 112 135 
①關于這兩種晶體的說法,不正確的是(填字母).
a.兩種晶體均為分子晶體
b.兩種晶體中的B-N鍵均為共價鍵
c.六方相氮化硼層間作用力小,所以質地軟
d.立方相氮化硼含有σ鍵和π鍵,所以硬度大
②六方相氮化硼晶體其結構與石墨相似卻不導電,原因是。
(7)石墨的晶胞結構如圖3所示。已知石墨的密度為ρg?cm-3,C-C鍵的鍵長為rcm,NA為阿伏加德羅常數的值,則石墨晶體的層間距d=cm。組卷:23引用:2難度:0.5


