2021-2022學年寧夏石嘴山三中高二(上)期中化學試卷
發布:2024/11/9 23:0:2
一、選擇題(本題共25個小題,每小題2分,共50分)
-
1.下列有關化學網絡用語的解釋錯誤的是( )
選項 網絡用語 解釋 A 你像膽礬一樣晶瑩剔透,我硫酸鋇了 你這個“250”,笑死我了 B 51號元素 美國內華達州的51區(Area 51) C Cl(aq)+H2(s)═Au(s)+Ag(s) 綠水青山就是金山銀山 D Nb Ce Cr Te Te 你是個弟弟 A.A B.B C.C D.D 組卷:9引用:1難度:0.8 -
2.下列說法正確的是(NA為阿伏加德羅常數)( )
A.1molNaCl晶胞中含有4NA個NaCl分子 B.一個銅晶胞的質量為 g64×2NAC.60gSiO2含有Si-O鍵的個數為2NA D.1molSiC含有C-Si鍵的個數為4NA 組卷:4引用:1難度:0.6 -
3.下列各組表述中,兩個微粒一定不屬于同種元素原子的是( )
A.3p能級有一個空軌道的基態原子和核外電子排布為1s22s22p63s23p2的原子 B.M層全充滿而N層為4s2的原子和核外電子排布為1s22s22p63s23p63d64s2的原子 C.最外層電子數是核外電子總數的 的原子和價電子排布為4s24p5的原子15D.2p能級有一個未成對電子的基態原子和原子的價電子排布為2s22p5的原子 組卷:270引用:31難度:0.7 -
4.下列說法正確的是( )
①不同元素組成的多原子分子中的化學鍵一定都為極性鍵
②第ⅠA族和第ⅦA族元素原子化合時,一定生成離子鍵
③含有離子鍵的化合物一定是離子化合物
④離子化合物中可能同時含有離子鍵和共價鍵
⑤晶體中有金屬陽離子,就一定有陰離子
⑥He晶體中相鄰He原子間存在范德華力A.②④ B.③④ C.③④⑥ D.②④⑥ 組卷:5引用:1難度:0.7 -
5.下列有關內容正確的是( )
選項 化學式 中心原子雜化方式 空間構型 鍵的極性 分子極性 A BF3 sp2 三角錐 極性鍵 非極性分子 B NF3 sp3 三角錐 極性鍵 非極性分子 C BF4- sp3 正四面體 非極性鍵 D N3- sp 直線 非極性鍵 A.A B.B C.C D.D 組卷:34引用:1難度:0.6 -
6.下列模型分別表示C2H2、S8、SF6的結構,下列說法正確的是( )

A.C2H2分子中σ 鍵和π鍵的物質的量比為1:2 B.上述三種物質形成的晶體類型不相同 C.SF6屬于非極性鍵形成的極性分子 D.S8中S原子都采用了sp3雜化 組卷:22引用:1難度:0.6 -
7.下列對分子結構及性質的敘述中正確的是( )
A.四氯化碳萃取碘水中碘,HCl易溶于水都可用“相似相溶”原理解釋 B.乳酸分子( 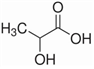 )中不存在手性碳原子
)中不存在手性碳原子C.P4( 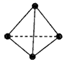 )和CH4分子的空間構型都是正四面體,鍵角都是109°28′,1mol CH4和1mol P4含有的σ鍵數目相同
)和CH4分子的空間構型都是正四面體,鍵角都是109°28′,1mol CH4和1mol P4含有的σ鍵數目相同D.丙烯腈 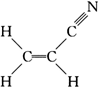 分子中,碳原子的雜化方式有sp3、sp2組卷:53引用:1難度:0.6
分子中,碳原子的雜化方式有sp3、sp2組卷:53引用:1難度:0.6 -
8.下列各組物質的晶體中,化學鍵類型相同、晶體類型也相同的是( )
A.CO2和SiO2 B.MgCl2和CaO2 C.SiO2和SiC D.氬和干冰 組卷:5引用:1難度:0.7 -
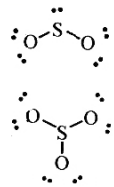 9.分子或離子中的大π鍵可表示為πxy,其中x表示參與形成大π鍵原子總數,y表示π電子數,已知π電子數=價電子總數-(σ電子對數+孤電子對數)×2。SO2和SO3的結構如圖所示:下列有關說法正確的是( )
9.分子或離子中的大π鍵可表示為πxy,其中x表示參與形成大π鍵原子總數,y表示π電子數,已知π電子數=價電子總數-(σ電子對數+孤電子對數)×2。SO2和SO3的結構如圖所示:下列有關說法正確的是( )A.中心原子S都采用sp3雜化 B.SO2的大π鍵可表示為π34,SO3的大π鍵可表示為π46 C.SO2和SO3都是極性鍵形成的極性分子 D.SO2與O3空間構型相似,SO3與SO32-空間構型相似 組卷:34引用:1難度:0.6 -
10.下列說法正確的是( )
A.硫酸氫鈉溶于水、加熱至熔融態都破壞了離子鍵和共價鍵 B.氯化氫氣體溶于水破壞了離子鍵,金剛石熔化破壞了共價鍵 C.冰→水→氫氣和氧氣依次破壞了氫鍵和范德華力,共價鍵 D.利用微機械剝離石墨制得石墨烯破壞了共價鍵和大π鍵 組卷:5引用:2難度:0.7 -
11.下列各組物質的沸點按由低到高的順序排列正確的是( )
A.NH3、CH4、NaCl、Na B.H2O、H2S、MgSO4、SO2 C.Li、Na、K、Rb、Cs D.Rb2O、BaO、CaO、MgO 組卷:25引用:1難度:0.7 -
12.下列說法中,正確的是( )
A.金屬晶體的熔、沸點一定比分子晶體的高 B.同類型原子晶體中,共價鍵的鍵長越短,鍵能越大,熔點就越高 C.分子內共價鍵越強,分子熱穩定性越強,其晶體熔沸點越高 D.離子晶體晶格能越大,熔沸點越高,導電能力越強 組卷:10引用:1難度:0.7 -
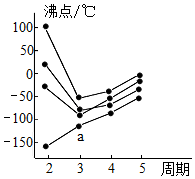 13.如圖中每條折線表示周期表ⅣA~ⅦA中的某一族元素氫化物的沸點變化。每個小黑點代表一種氫化物,其中a點代表的是( )
13.如圖中每條折線表示周期表ⅣA~ⅦA中的某一族元素氫化物的沸點變化。每個小黑點代表一種氫化物,其中a點代表的是( )A.H2S B.HCl C.PH3 D.SiH4 組卷:512引用:58難度:0.7 -
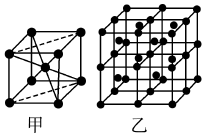 14.單質鐵的一種晶體如甲、乙所示,若按甲虛線方向切乙得到的圖應為( )
14.單質鐵的一種晶體如甲、乙所示,若按甲虛線方向切乙得到的圖應為( )A. 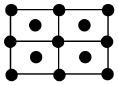
B. 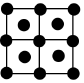
C. 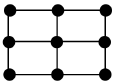
D. 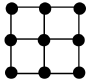 組卷:139引用:3難度:0.5
組卷:139引用:3難度:0.5 -
15.下列各組晶體物質均屬于分子晶體的是( )
A.SO2、SiO2、P2O5、O2 B.H2SO4、H2O2、HCl、Ar C.NH4Cl、H2O、NH3、I2 D.CO2、AlCl3、MgCl2、CO 組卷:67引用:2難度:0.7 -
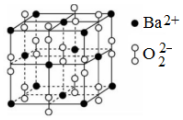 16.鋇在氧氣中燃燒時得到一種鋇的氧化物晶體,結構如圖所示,晶胞參數a=b=c,α=β=γ,下列有關說法正確的是( )
16.鋇在氧氣中燃燒時得到一種鋇的氧化物晶體,結構如圖所示,晶胞參數a=b=c,α=β=γ,下列有關說法正確的是( )A.該晶體屬于離子晶體,晶體的化學式為BaO B.該晶體中化學鍵類型只有離子鍵 C.該晶體晶胞結構與ZnS相似 D.O22-填入Ba2+堆積產生的八面體空隙,填隙率100% 組卷:36引用:2難度:0.6 -
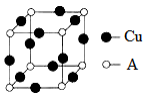
17.下列幾種物質的結構示意圖和化學式,正確的是( )
A B C D 
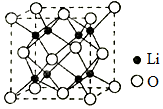
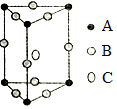
Mg3B2 Li2O A3B9C4 Mn2Bi A.A B.B C.C D.D 組卷:36引用:1難度:0.6
三、推斷題(本題共3個小題,共32分)
-
 52.A、B、C、D四種元素,A最高能級電子排布式為2p3,B元素的電負性是所有元素中最大的,其單質只能作氧化劑,C是第三周期元素,其第一到第五電離能(KJ?mol-1)數據依次為578、1817、2745、11575、14830,D原子核外有14種不同的運動狀態的電子,請回答下列問題:
52.A、B、C、D四種元素,A最高能級電子排布式為2p3,B元素的電負性是所有元素中最大的,其單質只能作氧化劑,C是第三周期元素,其第一到第五電離能(KJ?mol-1)數據依次為578、1817、2745、11575、14830,D原子核外有14種不同的運動狀態的電子,請回答下列問題:
(1)DB4分子中心原子雜化軌道類型為,AB3的分子構型為;CB3的熔點是1040℃,不溶于有機溶劑,則該晶體的晶體類型為。
(2)A、B兩元素形成的常見氣態氫化物的沸點A<B,其最主要的原因是。
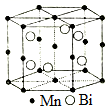
(3)A與銅元素形成的某種化合物的晶胞結構如圖所示,若該晶體的密度為ρg?cm-3,該晶體的晶胞參數
a=pm(設阿伏加德羅常數的值為NA)。組卷:5引用:1難度:0.6 -
53.金剛石、石墨、C60、碳納米管都是碳元素的單質形式,它們互為同素異形體,如圖依次是石墨、金剛石和C60的結構圖,回答問題
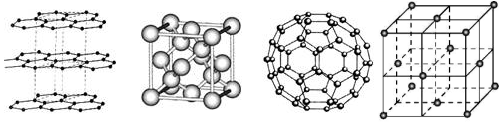
(1)石墨屬于晶體,石墨晶體中C的雜化方式為,層與層之間以結合,1mol石墨含有molC-Cσ鍵。
(2)金剛石晶體中C的雜化方式為,金剛石分子中的最小環為元環,一個環被個C原子共用,一個金剛石晶胞中有個C-Cσ鍵,晶胞中頂點原子坐標為(0,0,0),則晶胞內部其它原子坐標為。
(3)C60屬于晶體,一個C60晶胞的質量為g,每個 C60分子與個C60分子緊鄰,上圖第三張圖是C60的分子結構模型,在每個C60分子中形成的σ鍵數目為。
(4)C60能與金屬鉀化合生成具有超導性的K3C60,在K3C60中陰陽離子個數比為1:3,則K3C60屬于晶體。
(5)CO可以和很多過渡金屬形成配合物。金屬鎳粉在CO氣流中輕微地加熱,可生成液態的Ni(CO)4,用配位鍵表示Ni(CO)4 的結構為。
(6)科學發現,C和Ni、Mg元素的原子形成的晶體也具有超導性,其晶胞的結構特點如圖,則該晶胞中每個Mg原子周圍與它最近且距離相等的碳原子、鎂原子各有個,個。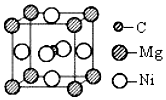 組卷:11引用:1難度:0.5
組卷:11引用:1難度:0.5


