2021-2022學年四川省眉山市彭山一中高三(上)入學化學試卷
發布:2024/12/18 12:30:2
一、選擇題
-
1.化學與生活密切相關。下列敘述錯誤的是( )
A.NaClO溶液可用來殺滅新冠病毒 B.可用淀粉溶液來檢驗是否為加碘鹽 C.制造醫用口罩的材料聚丙烯來自于石油化工 D.葡萄酒可用二氧化硫作防腐劑和抗氧化劑 組卷:46引用:3難度:0.8 -
2.能正確表示下列反應的離子方程式是( )
A.向次氯酸鈉溶液中通入足量SO2氣體:ClO-+SO2+H2O═HClO+HSO3- B.0.1mol/LNH4Al(SO4)2溶液與0.2mol/LBa(OH)2溶液等體積混合:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O C.用濃鹽酸酸化的KMnO4溶液與H2O2反應,證明H2O2具有還原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O D.Fe2O3溶于過量氫碘酸溶液中:Fe2O3+6H++2I-═2Fe2++I2+3H2O 組卷:18引用:3難度:0.9 -
3.設NA表示阿伏加德羅常數的值。下列敘述正確的是( )
A.1molCO2和SO2組成的混合物中含有的原子數為3NA B.2.24L的Cl2與一定量CH4在光照下反應生成的HCl分子數為0.1NA C.常溫下,0.1mol環氧乙烷( 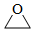 )中含有的共價鍵數為0.3NA
)中含有的共價鍵數為0.3NAD.7.8gNa2O2與水完全反應,轉移的電子數為0.2NA 組卷:7引用:1難度:0.7
二、非選擇題
-
10.軟錳礦是錳礦石的主要存在形式之一,其主要成分為MnO2,含有SiO2、Fe2O3、MgCO3、CaCO3等雜質,可用于制取在電池領域、涂料工業和農業上均有重要用途的MnSO4。某制備MnSO4的工藝流程如下:
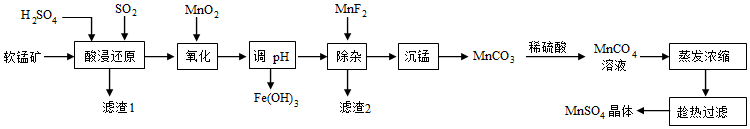
已知:①Fe(OH)3、Mn(OH)2的Ksp分別為1×10-39、4×10-14
②MnSO4的溶解度隨溫度變化的曲線如下圖所示
回答下列問題: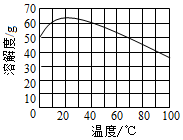
(1)“酸浸還原”發生的主要反應的化學方程式為。
(2)“酸浸還原”后鐵元素的存在形式為,濾渣1的主要成分是。
(3)根據綠色化學原則,“氧化”中可替代MnO2的物質是。若“氧化”后溶液中Mn2+濃度為1 mol/L,則“調pH”時為了確保Fe3+被沉淀完全(離子濃度不超過10-6mol/L)應控制的pH范圍為(已知lg2=0.3)。
(4)“濾渣2”的主要成分是。
(5)“沉錳”時加入的試劑為氨水-NH4HCO3混合溶液,寫出“沉錳”的離子方程式:。
(6)采用“趁熱過濾”操作的目的是。將分離出硫酸錳晶體后的母液收集起來循環使用,其意義是。組卷:22引用:2難度:0.6
[化學——選修3:物質結構與性質]
-
 11.ⅤA族元素及其化合物在生產、生活中用途廣泛。
11.ⅤA族元素及其化合物在生產、生活中用途廣泛。
(1)①P4S3常用于制造火柴,P和S的第一電離能較大的是。
②As4S4俗稱雄黃,其中基態As原子的價電子排布式為,有個未成對電子。
③P、S、As電負性由大到小的順序是。
(2)氫化物PH3、CH4、NH3的沸點由高到低的順序為。
(3)白磷在氯氣中燃燒可以得到PCl3和PCl5。氣態PCl3分子中P原子的軌道雜化方式為。
(4)超高導熱絕緣耐高溫納米氮化鋁在絕緣材料中應用廣泛,氮化鋁晶體與金剛石類似,每個鋁原子與個氮原子相連,與同一個氮原子相連的鋁原子構成的立體構型為。
(5)貴金屬磷化物Rh2P(化學式量為237)可用作電解水的高效催化劑,其立方晶胞如圖所示。已知晶胞參數為apm,晶體中與P距離最近的Rh的數目為,晶體的密度為g?cm-3。(列出計算式)組卷:41引用:3難度:0.5


