人教版(2019)選擇性必修1《4.1 原電池》2023年同步練習卷(11)
發布:2024/8/16 13:0:1
一、選擇題
-
 1.一種高性能的堿性硼化釩(VB2 )--空氣電池如圖所示,其中在VB2電極發生反應:VB2+16OH--11e-═+2B(OH)4-+4H2O該電池工作時,下列說法錯誤的是( )VO3-4
1.一種高性能的堿性硼化釩(VB2 )--空氣電池如圖所示,其中在VB2電極發生反應:VB2+16OH--11e-═+2B(OH)4-+4H2O該電池工作時,下列說法錯誤的是( )VO3-4A.負載通過0.04mol電子時,有0.224L(標準狀況)O2參與反應 B.正極區溶液的pH降低、負極區溶液的pH升高 C.電池總反應為4VB2+11O2+20OH-+6H2O═8B(OH)4-+4 VO3-4D.電流由復合碳電極經負載、VB2電極、KOH溶液回到復合碳電極 組卷:2079引用:34難度:0.5 -
2.科學家近年發明了一種新型Zn-CO2水介質電池。電池示意圖如圖,電極為金屬鋅和選擇性催化材料。放電時,溫室氣體CO2被轉化為儲氫物質甲酸等,為解決環境和能源問題提供了一種新途徑。下列說法錯誤的是( )
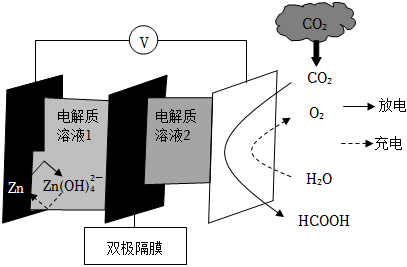
A.放電時,負極反應為Zn-2e-+4OH-═Zn(OH)42- B.放電時,1molCO2轉化為HCOOH,轉移的電子數為2mol C.充電時,電池總反應為2Zn(OH)42-═2Zn+O2↑+4OH-+2H2O D.充電時,正極溶液中OH-濃度升高 組卷:190引用:26難度:0.7 -
 3.為提升電池循環效率和穩定性,科學家近期利用三維多孔海綿狀Zn(3D-Zn)可以高效沉積ZnO的特點,設計了采用強堿性電解質的3D-Zn--NiOOH二次電池,結構如圖所示。電池反應為Zn(s)+2NiOOH(s)+H2O(l)ZnO(s)+2Ni(OH)2(s)。下列說法錯誤的是( )放電充電
3.為提升電池循環效率和穩定性,科學家近期利用三維多孔海綿狀Zn(3D-Zn)可以高效沉積ZnO的特點,設計了采用強堿性電解質的3D-Zn--NiOOH二次電池,結構如圖所示。電池反應為Zn(s)+2NiOOH(s)+H2O(l)ZnO(s)+2Ni(OH)2(s)。下列說法錯誤的是( )放電充電A.三維多孔海綿狀Zn具有較高的表面積,所沉積的ZnO分散度高 B.充電時陽極反應為Ni(OH)2(s)+OH-(aq)-e-═NiOOH(s)+H2O(l) C.放電時負極反應為Zn(s)+2OH-(aq)-2e-═ZnO(s)+H2O(l) D.放電過程中OH-通過隔膜從負極區移向正極區 組卷:2174引用:27難度:0.6 -
4.利用生物燃料電池原理研究室溫下氨的合成,電池工作時MV2+/MV+在電極與酶之間傳遞電子,示意圖如圖所示。下列說法錯誤的是( )

A.相比現有工業合成氨,該方法條件溫和,同時還可提供電能 B.陰極區,在氫化酶作用下發生反應H2+2MV2+═2H++2MV+ C.正極區,固氮酶為催化劑,N2發生還原反應生成NH3 D.電池工作時質子通過交換膜由負極區向正極區移動 組卷:1034引用:30難度:0.6 -
5.鋅-空氣燃料電池可用作電動車動力電源,電池的電解質溶液為KOH溶液,反應為2Zn+O2+4OH-+2H2O═2Zn(OH)42-.下列說法正確的是( )
A.充電時,電解質溶液中K+向陽極移動 B.充電時,電解質溶液中c(OH-)逐漸減小 C.放電時,負極反應為:Zn+4OH--2e-═Zn(OH)42- D.放電時,電路中通過2mol電子,消耗氧氣22.4L(標準狀況) 組卷:3699引用:59難度:0.9 -
 6.我國科學家研制了一種新型的高比能量鋅-碘溴液流電池,其工作原理示意圖如下。圖中貯液器可儲存電解質溶液,提高電池的容量。下列敘述不正確的是( )
6.我國科學家研制了一種新型的高比能量鋅-碘溴液流電池,其工作原理示意圖如下。圖中貯液器可儲存電解質溶液,提高電池的容量。下列敘述不正確的是( )A.放電時,a電極反應為I2Br-+2e-═2I-+Br- B.放電時,溶液中離子的數目增大 C.充電時,b電極每增重0.65g,溶液中有0.02mol I-被氧化 D.充電時,a電極接外電源負極 組卷:2087引用:28難度:0.5 -
7.下列關于原電池的敘述錯誤的是( )
A.原電池中的電解質不一定處于溶液狀態 B.若欲使原電池處于工作狀態,必須將其與外電路形成閉合回路 C.排在金屬活動性順序表前面的金屬總是作負極,排在后面的金屬總是作正極 D.負極總是發生氧化反應,正極總是發生還原反應 組卷:5引用:3難度:0.9
五、解答題
-
 20.某興趣小組用如圖裝置研究原電池的工作原理。
20.某興趣小組用如圖裝置研究原電池的工作原理。
(1)甲中K斷開時,裝置中發生反應的離子方程式為;K閉合時,Cu棒上的現象為,它為原電池的(填“正”或“負”)極,電極反應式為,外電路電流的方向由到(填“Cu”或“Zn”)。
(2)乙圖為氫氧燃料電池構造示意圖,其中通入氫氣的一極為電池的(填“正”或“負”)極,發生(填“氧化”或“還原”)反應。
(3)某同學欲把反應2Ag++Cu=Cu2++2Ag設計成原電池,請寫出負極的電極反應式:,電解質溶液為。
(4)下列反應通過原電池裝置,可實現化學能直接轉化為電能的是(填序號)。
①CaO+H2O=Ca(OH)2
②2H2+O2=2H2O
③2FeCl3+Cu=CuCl2+2FeCl2組卷:14引用:2難度:0.6 -
 21.鋰離子電池廣泛應用與日常電子產品中,也是電動汽車動力電池的首選.正極材料的選擇決定了鋰離子電池的性能.磷酸亞鐵鋰(LiFePO4)以其高倍率性、高比能量、高循環特征、高安全性、低成本、環保等優點而逐漸成為“能源新呈”.
21.鋰離子電池廣泛應用與日常電子產品中,也是電動汽車動力電池的首選.正極材料的選擇決定了鋰離子電池的性能.磷酸亞鐵鋰(LiFePO4)以其高倍率性、高比能量、高循環特征、高安全性、低成本、環保等優點而逐漸成為“能源新呈”.
(1)高溫固相法是磷酸亞鐵鋰生產的主要方法.通常以亞鐵鹽(如FeC2O4?2H2O)、磷酸鹽和鋰鹽為原料,按化學計量比充分混勻后,在惰性氣氛的保護中先經過較低溫預分解,再經過高溫焙燒,研磨粉碎制成.其反應原理如下:
Li2CO3+2FeC2O4?2H2O+2NH4H2PO4═NH3↑+3CO2↑+++.
①完成上述化學方程式.
②理論上,反應中每轉移0.15mol電子,會生成LiFePO4g.
③反應需在惰性氣氛的保護中進行,其原因是.
(2)磷酸鐵鋰電池裝置如圖所示,其中正極材料橄欖石型LiFePO4通過粘合劑附著在鋁箔表面,負極石墨材料附著在銅箔表面,電解質為溶解在有機溶劑中的鋰鹽.
電池工作時的總反應為:LiFePO4+6CLi1-xFePO4+LixC6,則放電時,正極的電極反應式為充電放電.充電時,Li+遷移方向為(填“由左向右”或“由右向左”),圖中聚合物隔膜應為(填“陽”或“陰”)離子交換膜.
(3)用該電池電解精煉銅.若用放電的電流強度I=2.0A的電池工作10分鐘,電解精煉銅得到銅0.32g,則電流利用效率為(保留小數點后一位).
(已知:法拉第常數F=96500C/mol,電流利用效率=×100%)負載利用電量電池輸出電量
(4)廢舊磷酸亞鐵鋰電池的正極材料中的LiFePO4難溶于水,可用H2SO4和H2O2的混合溶液浸取,發生反應的離子方程式為.組卷:67引用:1難度:0.9


