2021-2022學年黑龍江省大慶鐵人中學高二(上)開學化學試卷
發布:2024/4/20 14:35:0
一、選擇題(每小題只有一個選項正確,每小題3分,共18小題,共54分。)
-
1.如圖分別表示HCl、N2O4(g)、N2O4(l)的能量變化圖,有關說法不正確的是( )
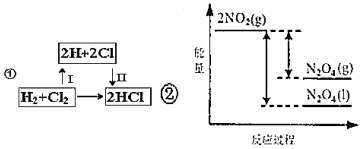
A.①中步驟Ⅰ和Ⅱ的變化過程都會放出熱量 B.由②可以看出化學反應中的能量變化的大小與物質的狀態有關 C.化學鍵的斷裂與形成是化學反應發生能量變化的主要原因 D.化學反應中的能量變化取決于反應物的總能量與生成物的總能量的相對大小 組卷:45引用:2難度:0.7 -
2.下列關于化學反應速率的說法正確的是( )
①有氣體參加的化學反應,若增大壓強(即縮小反應容器的體積),可增加活化分子數目,從而使反應速率增大。
②其他條件不變,溫度越高,化學反應速率越快。
③6mol?L-1?s-1的反應速率一定比3.5mol?L-1?s-1的反應速率大。
④升高溫度能增大反應物分子中活化分子的百分數。
⑤恒溫時,增大壓強,化學反應速率一定加快。
⑥增大反應物濃度,可增大活化分子的百分數,從而使單位時間有效碰撞次數增多。A.①②⑤ B.②④ C.②⑤ D.③⑥ 組卷:200引用:5難度:0.6 -
3.提供幾組常見的實驗裝置示意圖,下列有關敘述正確的是( )
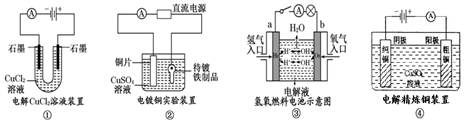
A.裝置①中陽極上有無色無味氣體冒出 B.裝置②中的銅片應與直流電源的負極相連 C.裝置③中,若電解液為KOH溶液,則電極a的反應式:H2-2e-+2OH-=2H2O D.裝置④陽極減少的質量一定等于陰極增加的質量 組卷:68引用:2難度:0.7 -
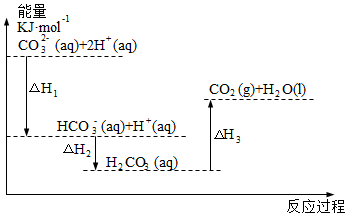 4.向Na2CO3溶液中滴加鹽酸,反應過程中能量變化如圖所示,下列說法不正確的是( )
4.向Na2CO3溶液中滴加鹽酸,反應過程中能量變化如圖所示,下列說法不正確的是( )A.反應HCO3-(aq)+H+(aq)═CO2(g)+H2O(l)為吸熱反應 B.ΔH1<ΔH2,ΔH2<ΔH3 C.CO32-(aq)+2H+(aq)═CO2(g)+H2O(l) ΔH=ΔH1+ΔH2+ΔH3 D.H2CO3(aq)═CO2(g)+H2O(l),若使用催化劑,則ΔH3變小 組卷:46引用:2難度:0.5 -
5.按如圖所示裝置進行下列不同的操作,說法不正確的是( )
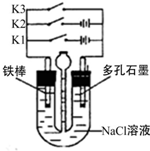
A.只接通K3,一段時間后,漏斗液面上升 B.只接通K1,一段時間后,U形管中出現白色沉淀 C.只接通K2,U形管左、右兩端液面均下降 D.鐵腐蝕的速度由大到小的順序是:只接通K1>只接通K3>都斷開>只接通K2 組卷:15引用:3難度:0.7 -
6.將等物質的量的A、B混合于2L的密閉容器中,發生如下反應:3A(g)+B(g)?xC(g)+2D(g,經6min后測得D的濃度為0.75mol/L,c(A):c(B)═3:5,以C表示的平均反應速率v(C)═0.125mol/(L?min),下列說法不正確的是( )
A.以A表示的平均反應速率為v(A)=0.1875mol/(L?min) B.該反應方程式中,x=2 C.6min時,轉化了的A占起始A的25% D.6min時,C的物質的量分數為 16組卷:15引用:1難度:0.5 -
7.在3種不同條件下,分別向容積為2 L的恒容密閉容器中充入2 mol A和1 mol B,發生反應:2A(g)+B(g)?2D(g) ΔH=Q kJ?mol-1。相關條件和數據見下表:
下列說法正確的是( )實驗編號 實驗Ⅰ 實驗Ⅱ 實驗Ⅲ 反應溫度/℃ 700 700 750 達平衡時間/min 40 5 30 n(D)平衡/mol 1.5 1.5 1 化學平衡常數 K1 K2 K3 A.K3<K2=K1 B.實驗Ⅱ可能壓縮體積 C.實驗Ⅰ達平衡后容器內的壓強是實驗Ⅲ的 109D.實驗Ⅲ達平衡后,恒溫下再向容器中通入1molA和1molD,平衡正向移動 組卷:10引用:1難度:0.4
二、填空題(共46分)
-
21.
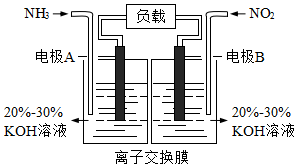 電化學知識在物質制備領域的應用前景看好。
電化學知識在物質制備領域的應用前景看好。
(1)利用反應6NO2+8NH3=7N2+12H2O構成電池的方法,既能實現有效消除氮氧化物的排放,減輕環境污染,又能充分利用化學能,裝置如圖所示。
①A電極的電極反應式為。
②下列關于該電池的說法正確的是。
A.電子從右側電極經過負載后流向左側電極
B.為使電池持續放電,離子交換膜需選用陰離子交換膜
C.電池工作一段時間,溶液的pH不變
D.當有4.48 LNO2被處理時,轉移電子物質的量為0.8mol
(2)以甲烷為燃料的新型電池,其成本大大低于以氫氣為燃料的傳統燃料電池,目前得到廣泛的研究,如圖是目前研究較多的一類固體氧化物燃料電池工作原理示意圖。回答下列問題: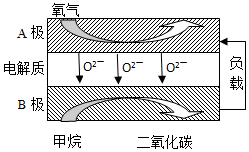
①B極上的電極反應式為。
②若用該燃料電池作電源,用石墨作電極電解硫酸銅溶液,當陽極收集到11.2 L(標準狀況)氣體時,消耗甲烷的體積為L(標準狀況下)。
(3)陽離子交換膜法電解飽和食鹽水具有綜合能耗低、環境污染小等優點。生產流程如圖所示:
①電解飽和食鹽水的化學方程式為。
②電解結束后,能夠脫去陽極液中游離氯的試劑或方法是(填字母序號)。
A.Na2SO4
B.Na2SO3
C.熱空氣吹出
D.降低陽極區液面上方的氣壓
(4)按如圖1所示裝置進行電解,A、B、C、D均為鉑電極,回答下列問題。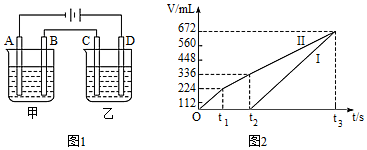
已知一:甲槽電解的是200 mL一定濃度的NaCl與CuSO4的混合溶液,理論上兩極所得氣體體積隨時間變化的關系如圖2所示(氣體體積已換算成標準狀況下的體積,電解前后溶液的體積變化忽略不計)。
①原混合溶液中NaCl的物質的量濃度為mol?L-1,CuSO4的物質的量濃度為mol?L-1。
已知二:乙槽為200 mL CuSO4溶液:
②當C極析出0.64 g物質時,乙槽溶液中生成的H2SO4為mol。電解后,若使乙槽內的溶液完全復原,可向乙槽中加入。
A.Cu(OH)2
B.CuO
C.CuCO3
D.Cu2(OH)2CO3
③若通電一段時間后,向所得的乙槽溶液中加入0.2 mol的Cu(OH)2才能恰好恢復到電解前的濃度,則電解過程中轉移的電子數為(用NA表示)。組卷:96引用:1難度:0.5 -
 22.氮的化合物種類繁多,性質也各不相同。請回答下列問題:
22.氮的化合物種類繁多,性質也各不相同。請回答下列問題:
(1)已知:①SO3(g)+NO(g)=NO2(g)+SO2(g)△H1=+41.8mol?L-1
②2SO2(g)+O2(g)=2SO3(g)△H2=-196.6mol?L-1
則2NO2(g)=2NO(g)+O2(g)的△H=。
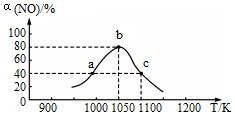
(2)NO作為主要空氣污染物,其主要來源是汽車尾氣,研究人員用活性炭對汽車尾氣中的NO進行吸附,并發生反應:C(s)+2NO(g)?N2(g)+CO2(g)△H<0。在恒壓密閉容器中加入足量活性炭和一定量NO氣體,反應相同時間時,測得NO的轉化率α(NO)隨溫度的變化如圖所示:
圖中a、b、c三點中,達到平衡的點是;溫度為1100K時,N2的平衡體積分數為。
(3)現代技術用氨氣將汽車尾氣中的NOx還原為N2和H2O,反應原理是NO(g)+NO2(g)+2NH3(g3H2O(g)+2N2(g)△H<0。催化劑
①實際生產中NO(g)+NO2(g)+2NH3(g)3H2O(g)+2N2(g)的反應溫度不宜過高的原因是催化劑。
②500℃時,在2L恒容密閉容器中充入1molNO、1molNO2和2molNH3,8min時反應達到平衡,此時NH3的轉化率為40%,體系壓強為p0MPa,則0~8min內用N2表示的平均反應速率v(N2)=,500℃時該反應的平衡常數Kp=MPa(用含p0的代數式表示,Kp為以分壓表示的平衡常數,分壓=總壓×物質的量分數)。組卷:14引用:4難度:0.4


