2020-2021學(xué)年河南省鄭州市郊縣高二(上)期中化學(xué)試卷
發(fā)布:2024/11/23 2:30:1
一、選擇題:本題共16小題,每小題3分,共48分.在每小題給出的四個(gè)選項(xiàng)中,只有一個(gè)選項(xiàng)符合題意.
-
1.下列有關(guān)反應(yīng)熱的敘述正確的是( )
A.濃硫酸與NaOH溶液混合,生成1mol水時(shí)的反應(yīng)熱代表中和熱 B.若反應(yīng)的△H和△S均為負(fù)值,則任何溫度,反應(yīng)均可自發(fā)進(jìn)行 C.含20.0gNaOH的稀溶液與稀鹽酸完全中和,放出28.7kJ的熱量,則表示該反應(yīng)中和熱的熱化學(xué)方程式為NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(1)△H=-57.4kJ?mol-1 D.若CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-812.3kJ?mol-1,則甲烷的燃燒熱為812.3kJ?mol-1 組卷:4引用:1難度:0.6 -
2.某化學(xué)反應(yīng)的能量變化如圖所示,下列有關(guān)敘述正確的是( )
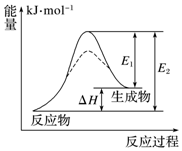
A.該反應(yīng)為放熱反應(yīng) B.加入催化劑,可同時(shí)降低E1、E2 C.該反應(yīng)的反應(yīng)熱△H=(E1-E2) kJ?mol-1 D.E2可表示形成新的化學(xué)鍵所釋放的能量 組卷:44引用:4難度:0.6 -
3.用鐵片與稀硫酸反應(yīng)制取氫氣時(shí),下列措施不能使氫氣生成速率加大的是( )
A.加熱 B.不用鐵片,改用鐵粉 C.滴加少量CuSO4溶液 D.不用稀硫酸,改用98%濃硫酸 組卷:58引用:2難度:0.8 -
 4.電化學(xué)現(xiàn)象在生活中無(wú)處不在,炒過(guò)菜的鐵鍋未及時(shí)洗凈(殘液中含NaCl),不久會(huì)因被腐蝕而出現(xiàn)紅褐色銹斑,腐蝕原理如圖所示.下列說(shuō)法正確的是( )
4.電化學(xué)現(xiàn)象在生活中無(wú)處不在,炒過(guò)菜的鐵鍋未及時(shí)洗凈(殘液中含NaCl),不久會(huì)因被腐蝕而出現(xiàn)紅褐色銹斑,腐蝕原理如圖所示.下列說(shuō)法正確的是( )A.腐蝕過(guò)程總反應(yīng)式為Fe+2H+=H2↑+Fe2+ B.腐蝕過(guò)程中,溶液中陽(yáng)離子從C電極移向Fe電極 C.腐蝕過(guò)程中C為正極,C電極表面上發(fā)生還原反應(yīng) D.反應(yīng)中Fe失去電子,電子經(jīng)電解質(zhì)溶液從Fe電極移向C電極 組卷:9引用:2難度:0.5 -
5.下列現(xiàn)象不能用化學(xué)平衡移動(dòng)原理解釋的是( )
A.Cl2+H2O?HCl+HClO,向新制氯水中加入碳酸鈣,漂白性增強(qiáng) B.2HI(g)?H2(g)+I2(g),達(dá)平衡后縮小容器容積可使體系顏色變深 C.2NO2(g)?N2O4(g)△H<0,將裝有NO2的玻璃球浸入熱水中,紅棕色變深 D.Cr2O72-(橙色)+H2O?2CrO42-(黃色)+2H+,向K2Cr2O7溶液中滴加幾滴濃硫酸,橙色加深 組卷:25引用:4難度:0.6 -
6.將0.2mol X和0.2mol Y充入2L的密閉容器中發(fā)生如下反應(yīng):X(g)+3Y(g)?2Z(g)+aQ(g),2min達(dá)到平衡時(shí)生成0.08mol Z,測(cè)得Q的濃度為0.04mol?L-1,下列敘述正確的是( )
A.a(chǎn)的值為1 B.平衡時(shí)X的濃度為0.02mol?L-1 C.Y的轉(zhuǎn)化率為30% D.v(Y)=0.03mol?L-1?min-1 組卷:3引用:2難度:0.5 -
 7.利用如圖所示裝置,當(dāng)X、Y選用不同材料時(shí),可將電解原理廣泛應(yīng)用于工業(yè)生產(chǎn)。下列說(shuō)法中正確的是( )
7.利用如圖所示裝置,當(dāng)X、Y選用不同材料時(shí),可將電解原理廣泛應(yīng)用于工業(yè)生產(chǎn)。下列說(shuō)法中正確的是( )A.氯堿工業(yè)中,Y可為鐵棒,加酚酞溶液,X附近首先變紅 B.銅的精煉中,X是純銅,Y是粗銅,Z是CuSO4溶液 C.海水提鎂中,X、Y均為石墨,Z為MgCl2溶液 D.電鍍工業(yè)中,X是鍍層金屬,Y是待鍍金屬 組卷:5引用:1難度:0.5
二、非選擇題:本題共5小題,共52分.
-
20.合成氨是人類(lèi)科學(xué)技術(shù)上的一項(xiàng)重大突破,其反應(yīng)原理為:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1。一種工業(yè)合成氨的簡(jiǎn)易流程圖如圖:

(1)步驟Ⅱ中制氫氣原理如下:
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.4kJ?mol-1
②CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ?mol-1
①對(duì)于反應(yīng)①,一定可以提高平衡體系中H2的體積分?jǐn)?shù),又能加快反應(yīng)速率的是。
a.升高溫度
b.增大水蒸氣濃度
c.加入催化劑
d.降低壓強(qiáng)
②對(duì)于反應(yīng)②,t℃時(shí),往2L密閉容器中充入0.4mol CO和0.6mol水蒸氣,反應(yīng)建立平衡后,體系中c(H2)=0.12mol?L-1。該溫度下此反應(yīng)的平衡常數(shù)K=;保持溫度不變,向上述體系中再加入0.2molCO,當(dāng)反應(yīng)重新達(dá)到平衡時(shí),水蒸氣的總的轉(zhuǎn)化率為α(H2O)=。
(2)如圖表示500℃、60.0MPa條件下,原料氣投料比與平衡時(shí)NH3體積分?jǐn)?shù)的關(guān)系.根據(jù)圖中a點(diǎn)數(shù)據(jù)計(jì)算N2的平衡體積分?jǐn)?shù):。
(3)上述流程圖中,使合成氨放出的熱量得到充分利用的主要步驟是(填序號(hào)),簡(jiǎn)述本流程中提高合成氨原料總轉(zhuǎn)化率的方法:(任寫(xiě)兩條)。組卷:7引用:1難度:0.5 -
21.二甲醚是一種重要的清潔燃料,可替代氟氯代烷作制冷劑,利用水煤氣合成二甲醚的三步反應(yīng)如下:
2H2(g)+CO(g)=CH3OH(g)△H=-90.8kJ?mol-1
2CH3OH(g)=CH3OCH3(g)+H2O(g)△H=-23.5kJ?mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.2kJ?mol-1
請(qǐng)回答下列問(wèn)題:
(1)由H2和CO直接制備二甲醚的總反應(yīng):3H2(g)+3CO(g)=CH3OCH3(g)+CO2(g)的ΔH=kJ?mol-1。
(2)某溫度下反應(yīng)v正2CH3OH(g)?CH3OCH3(g)+H2O(g)的平衡常數(shù)為400.此溫度下,在密閉容器中加入CH3OH,反應(yīng)到某時(shí)刻測(cè)得各組分的濃度如下:
①比較此時(shí)正、逆反應(yīng)速率的大小:v正物質(zhì) CH3OH CH3OCH3 H2O 濃度/(mol?L-1) 0.44 0.6 0.6 v逆(填“>”“<”或“=”)。
②若加入CH3OH后,經(jīng)10min反應(yīng)達(dá)到平衡,此時(shí)c( CH3OH)=mol?L-1,該時(shí)間段內(nèi)c(CH3OH)=mol?L-1?min-1。
(3)如圖是二甲醚燃料電池的工作原理示意圖。
①該燃料電池的負(fù)極反應(yīng)式為。
②若用該電池電解足量的硫酸鈉水溶液,消耗46g二甲醚后,在電解池兩端共收集到134.4L(標(biāo)準(zhǔn)狀況)氣體,則該裝置的能量利用率為%(結(jié)果保留三位有效數(shù)字)。組卷:4引用:1難度:0.4


