2015-2016學年安徽省安慶市懷寧中學高三(上)開學化學試卷
發布:2024/4/20 14:35:0
一、本大題包括20小題,每小題只有一個選項符合題意.
-
1.日前中國量子物質科學協同創新中心的江穎課題組和王恩哥課題組合作,在水科學領域取得重大突破,在國際上首次實現了水分子的亞分子級分辨成像,使得解析水的氫鍵網絡構型成為可能.(圖a是實驗器件示意圖,圖b是拍攝到的圖片的一部分,圖c是圖b所對應的結構示意圖)下列有關說法不正確的是( )

A.圖a所示實驗器件中,用氯化鈉作為絕緣薄膜層,是因為氯化鈉晶體不導電 B.圖b是表示一個H2O分子內部的氫鍵和氫氧共價鍵結構特征示意圖 C.水分子間形成氫鍵使水的熔點和沸點升高 D.H2O分子的穩定性很強,是因為分子內氫氧共價鍵強 組卷:27引用:1難度:0.9 -
2.化學科學需要借助化學專用語言描述,下列有關化學用語正確的是( )
A.HClO的結構式:H-Cl-O B.Na2O2的電子式: 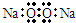
C.中子數為20的氯原子: Cl2017D.鋁原子的結構示意圖  組卷:10引用:5難度:0.9
組卷:10引用:5難度:0.9 -
3.以下非金屬氧化物與其引起的環境問題及主要來源對應正確的是( )
氧化物 環境問題 主要來源 A CO2 酸雨 化石燃料的燃燒 B SO2 光化學煙霧 汽車尾氣的排放 C NO2 溫室效應 工廠廢氣的排放 D CO 煤氣中毒 煤炭的不完全燃燒 A.A B.B C.C D.D 組卷:103引用:6難度:0.9 -
4.常溫下,下列各組粒子在指定溶液中能量共存的是( )
A.在酸性KMnO4溶液中:Na+、C2H5OH、 、Cl-NH+4B.能溶解CaCO3的溶液中:Fe2+、Ca2÷、Cl-、 NO-3C.澄清透明的溶液中:Cu2+、Mg2+、 、Cl-SO2-4D.能使淀粉-KIO3試紙顯藍色的溶液中:K+、H+、 、I-SO2-4組卷:59引用:7難度:0.9 -
5.下列有關實驗裝置進行的相應實驗,能達到實驗目的的是( )
A. 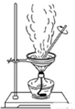
利用此圖裝置可從氯化鐵溶液中直接蒸發結晶獲得氯化鐵晶體B. 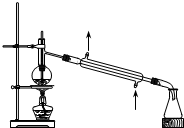
利用此圖裝置可分離石油,得到汽油、煤油和柴油等各種餾分C. 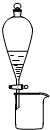
利用此圖裝置可分離CH3CH2OH和CH3COOC2H5混合液D. 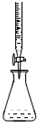
利用此圖裝置可進行酸堿中和滴定組卷:14引用:3難度:0.7 -
6.汽車尾氣主要的危害是形成光化學煙霧,危害人類健康.HNCO可用于消除汽車尾氣中的NO和NO2,其反應原理為:HNCO+NOx→N2+CO2+H2O,下列說法正確的是( )
A.CO2分子中既含有極性鍵又含有非極性鍵 B.4.3g HNCO中含有0.1NA個原子 C.反應中NOx是還原劑 D.若NOx中x=2,1mol NO2在反應中轉移4NA個電子 組卷:17引用:4難度:0.7 -
7.設nA為阿伏加德羅常數的數值,下列說法正確的是( )
A.0.1molNa與足量O2反應,轉移0.2nA個電子 B.1L 0.1mol?L-1Na2S溶液中含有0.1nA個S2- C.常溫下,44gCO2含有nA個C原子 D.標準狀況下,22.4L的CCl4含有4nA個Cl原子 組卷:0引用:2難度:0.7 -
8.下列表示對應化學反應的離子方程式正確的是( )
A.Na2CO3溶液的水解: +H3O+?CO2-3+H2OHCO-3B.AlCl3溶液中滴加濃氨水至過量:Al3++4NH3?H2O= +4AlO-2+2H2ONH+4C.氯化亞鐵溶液中加入硝酸:3Fe2++4H++ =3Fe3++2H2O+NO↑NO-3D.向NaHSO4溶液中加入過量Ba(OH)2溶液:Ba2++2OH-+2H++ =BaSO4↓+2H2OSO2-4組卷:5引用:3難度:0.7
二、本題包括4小題,共50分.
-
23.鐵、銅單質及其化合物應用范圍很廣。現有含氯化亞鐵雜質的氯化銅晶體(CuCl2?2H2O),為制取純凈的CuCl2?2H2O,首先將其制成水溶液,然后按如圖步驟進行提純:
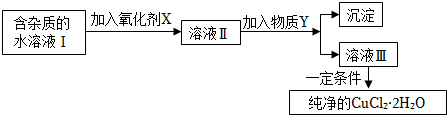
已知Cu2+、Fe3+和Fe2+的氫氧化物開始沉淀和沉淀完全時的pH,見表:
請回答下列問題。Fe3+ Fe2+ Cu2+ 氫氧化物開始沉淀時的PH 1.9 7.0 4.7 氫氧化物完全沉淀時的PH 3.2 9.0 6.7
(1)最適合作氧化劑X的是。
A.K2Cr207 B.NaClO C.H2O2 D.KMnO4
(2)加入的物質Y是。
A.CuO B.NaOH C.Cu2(OH)2CO3D.NH3
(3)由溶液Ⅲ獲得CuCl2?2H2O,需要經過、、過濾操作。
(4)測定溶液Ⅰ中Fe2+的濃度,可用KMnO4標準溶液滴定,取用KMnO4溶液應使用(“酸式”或“堿式”)滴定管。反應的化學方程式:。組卷:10引用:5難度:0.1 -
24.汽車尾氣中二氧化硫、氮氧化物和可吸入顆粒物是霧霾主要組成。某課題組用汽車尾氣為原料探究二氧化硫、氮氧化物的化學性質。
I.汽車尾氣(含有烴類、CO、SO2與NO等物質),治理的方法之一是在汽車的排氣管上裝一個“催化轉換器”(用鉑、鈀合金作催化劑)。它的特點是使CO與NO反應,生成可參與大氣生態環境循環的無毒氣體,并促使烴類充分燃燒及SO2的轉化。寫出一氧化碳與一氧化氮反應的化學方程式:
Ⅱ.課題組欲在綠色環保的條件下探究大氣污染物SO2的性質,設計如圖實驗裝置。請回答: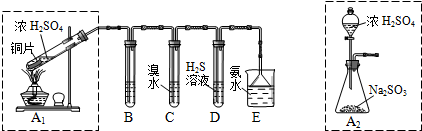
(1)B、C、D分別用于檢驗SO2的漂白性、還原性和氧化性,則B中所盛試劑為;
C中反應的離子方程式為。
(2)為了實現綠色環保的目標,制取SO2裝置最好選擇。(A1或A2裝置)用氨水吸收尾氣中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等陰離子。請回答:
(3)氨水吸收過量SO2的反應的離子方程式為。
(4)已知亞硫酸氫鹽一般易溶于水,SO2也易溶于水。現有儀器和試劑為:小燒杯、試管、玻璃棒、膠頭滴管、過濾裝置和濾紙;2mol/L鹽酸、2mol/LHNO3、1mol/LBaCl2溶液、l mol/LBa(OH)2溶液、品紅溶液、蒸餾水。請設計實驗證明“吸收液”中存在SO32-、HSO3-,完成下表的實驗操作、預期現象和結論:實驗操作 預期現象與結論 步驟1:取適量“吸收液”于小燒杯中,用膠頭滴管取l mol/L BaCl2溶液向小燒杯滴加直至過量。 若出現白色渾濁,則溶液中存在SO32-或 SO42-. 步驟2:將小燒杯中的濁液過濾、洗滌,再用適量水把附在濾紙上的固體沖入另一小燒杯中;向沖下的固體 。
步驟3:組卷:4引用:1難度:0.5


