2020-2021學年寧夏吳忠市青銅峽高級中學高二(下)第一次月考化學試卷
發布:2024/4/20 14:35:0
一、選擇題(每小題只有一個正確答案,每題2分共48分)
-
1.下列現象和應用與電子躍遷無關的是( )
A.激光 B.焰色反應 C.原子光譜 D.石墨導電 組卷:86引用:8難度:0.9 -
2.下列判斷正確的是( )
A.根據同周期元素的第一電離能變化趨勢,推出Al的第一電離能比Mg大 B.根據主族元素最高正化合價與族序數的關系,推出鹵族元素最高正價都是+7 C.晶體中一定存在化學鍵 D.正四面體分子中鍵角可能是109°28′或60° 組卷:66引用:11難度:0.7 -
3.下列物質的分子中,既有σ鍵又有π鍵的是( )
A.C2H6 B.HClO C.CH4 D.CO2 組卷:30引用:5難度:0.9 -
4.下列晶體中屬于原子晶體的是( )
A.干冰 B.食鹽 C.金剛石 D.氖 組卷:70引用:7難度:0.9 -
5.對Na、Mg、Al的有關性質的敘述正確的是( )
A.堿性:NaOH<Mg(OH)2<Al(OH)3 B.第一電離能:Na<Mg<Al C.電負性:Na>Mg>Al D.還原性:Na>Mg>Al 組卷:93引用:71難度:0.7 -
6.某元素原子的價電子構型為3d54s2,其應在( )
A.第四周期ⅡA族 B.第四周期ⅡB族 C.第四周期ⅦA族 D.第四周期ⅦB族 組卷:47引用:31難度:0.9 -
7.某元素原子的質量數為52,中子數為28,其基態原子未成對電子數為( )
A.1 B.3 C.4 D.6 組卷:92引用:14難度:0.9 -
8.若aAm+與bBn-的核外電子排布相同,則下列關系不正確的是( )
A.b=a-n-m B.離子半徑Am+<Bn- C.原子半徑A<B D.A的原子序數比B大(m+n) 組卷:33引用:28難度:0.9 -
9.已知X、Y元素同周期,且電負性X>Y,下列說法錯誤的是( )
A.X與Y形成化合物是,X可以顯負價,Y顯正價 B.第一電離能可能Y小于X C.最高價含氧酸的酸性:X對應的酸性弱于Y對應的 D.氣態氫化物的穩定性:HmY小于HmX 組卷:139引用:41難度:0.9
二、填空題
-
28.已知A、B、C、D、E五種元素的原子序數依次增大,其中A原子所處的周期數、族序數都與其原子序數相等;B原子核外電子有6種不同的運動狀態,s軌道電子數是p軌道電子數的兩倍;D原子L電子層上有2對成對電子;E+原子核外有3層電子且各層均處于全滿狀態.
請填寫下列空白.
(1)E元素基態原子的核外電子排布式為.
(2)B、C、D三種元素的第一電離能數值由小到大的順序為(填元素符號),其原因為.
(3)B2A4是重要的基本石油化工原料.B2A4分子中B原子軌道的雜化類型為;1mol B2A4分子中含molσ鍵.
(4)已知D、E能形成晶胞如圖所示的兩種化合物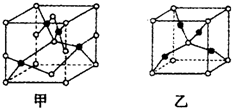 ,化合物的化學式,甲為,乙為;高溫時,甲易轉化為乙的原因為.組卷:37引用:7難度:0.3
,化合物的化學式,甲為,乙為;高溫時,甲易轉化為乙的原因為.組卷:37引用:7難度:0.3 -
29.現有六種元素,其中A、B、C、D為短周期主族元素,E、F為第四周期元素,它們的原子序數依次增大.請根據下列相關信息,回答問題.
(1)A基態原子中能量最高的電子,其電子云在空間有A元素原子的核外p電子總數比s電子總數少1 B元素原子核外s電子總數與p電子總數相等,且不與A元素在同一周期 C原子核外所有p軌道全滿或半滿 D元素的主族序數與周期數的差為4 E是前四周期中電負性最小的元素 F在周期表的第七列 個方向,原子軌道呈形.
(2)某同學根據上述信息,所畫的B電子排布圖如圖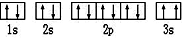 ,違背了原理.
,違背了原理.
(3)F位于族區,其基態原子有種運動狀態.
(4)CD3中心原子的雜化方式為,用價層電子對互斥理論推測其分子空間構型為,檢驗E元素的方法是.
(5)若某金屬單質晶體中原子的堆積方式如圖甲所示,其晶胞特征如圖乙所示,原子之間相互位置關系的平面圖如圖丙所示.則晶胞中該原子的配位數為,該單質晶體中原子的堆積方式為四種基本堆積方式中的.若已知該金屬的原子半徑為d cm,NA代表阿伏加德羅常數,金屬的相對原子質量為M,則該晶體的密度為g?cm-3(用字母表示).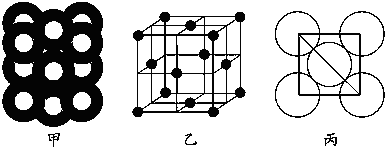 組卷:2引用:3難度:0.3
組卷:2引用:3難度:0.3


