2019-2020學年江蘇省南京市高二(上)周練化學試卷(11)
發布:2025/1/6 8:0:14
一、不定項選擇題(共8小題,每小題3分,滿分21分)
-
1.室溫下,下列各組離子在指定溶液中能大量共存的是( )
A.0.1 mol?L-1KI溶液:Na+、K+、ClO-、OH- B.0.1mol?L-1Fe2(SO4)3溶液:Cu2+、NH4+,NO3,SO42- C.0.mol?L-1HCl溶液:Ba2+、K+、CH3COO-、NO3- D.0.1 mol?L-1 NaOH溶液:Na+、K-、CO32-、AlO2- 組卷:10引用:1難度:0.7 -
2.常溫下,下列各組離子在指定溶液中能大量共存的是( )
A.無色透明的溶液中:Fe3+、Mg2+、SCN -、Cl - B. =1×10-12的溶液中:K+、Na+、CO32-、NO3-c(H+)c(OH-)C.c(Fe2+)=1mol?L-1的溶液中:K+、NH4+、MnO4-、SO42- D.能使甲基橙變紅的溶液中:Na+、NH4+、SO42-、HCO3- 組卷:2932引用:36難度:0.7 -
3.下列有關說法正確的是( )
A.若在海輪外殼上附著一些銅塊,則可以減緩海輪外殼的腐蝕 B.2NO(g)+2CO(g)═N2(g)+2CO2(g)在常溫下能自發進行,則該反應的△H>0 C.加熱0.1mol?L-1Na2CO3溶液,CO32-的水解程度和溶液的pH均增大 D.對于乙酸與乙醇的酯化反應(△H<0),加入少量濃硫酸并加熱,該反應的反應速率和平衡常數均增大 組卷:256引用:17難度:0.9
二、綜合解答題(共2小題,滿分0分)
-
11.鋁是應用廣泛的金屬,以鋁土礦(主要成分為Al2O2,含SiO2和Fe2O3等雜質)為原料制備鋁的一種工藝流程如圖
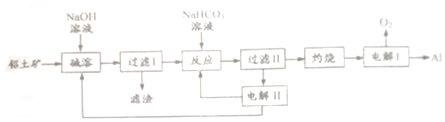
注:SO2在“堿溶”時轉化為鋁硅酸鈉沉淀。
(1)“堿溶”時生成偏鋁酸鈉的化學方程式為。過濾Ⅰ濾渣主要成分有。
(2)向“過濾Ⅰ”所得濾液中加入NaHCO3溶液,離子反應方程式為,溶液的pH(填“增大”、“不變”或“減小”)。
(3)“電解Ⅰ”是電解熔融Al2O3,電解過程中作陽極的石墨易消耗,原因是。
(4)“電解Ⅱ”是電解Na2CO3溶液,原理如圖所示,請回答問題。
①如圖中a,b是鋁土礦制備鋁的流程中可循環利用的物質,它們分別是,。
②陽極的電極反應式為,陰極產生的氣體A的化學式為。
(5)鋁粉在1000℃時可與N2反應制備AlN.在鋁粉中添加少量NH4Cl固體并充分混合,有利于AlN的制備,其主要原因是。組卷:10引用:1難度:0.4 -
12.實驗室以工業廢渣(主要含CaSO4?2H2O,還含少量SiO2、Al2O3、Fe2O3)為原料制取輕質CaCO3和(NH4)2SO4晶體,其實驗流程如圖:
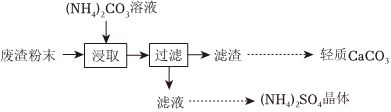
(1)室溫下,反應CaSO4(s)+(aq)?CaCO3(s)+CO2-3(aq)達到平衡,則溶液中SO2-4=c(SO2-4)c(CO2-3)[Ksp(CaSO4)=4.8×10-5,Ksp(CaCO3)=3×10-9]。
(2)將氨水和NH4HCO3溶液混合,可制得(NH4)2CO3溶液,其離子方程式為;浸取廢渣時,向(NH4)2CO3溶液中加入適量濃氨水的目的是。
(3)廢渣浸取在如圖所示的裝置中進行。控制反應溫度在60~70℃,攪拌,反應3小時。溫度過高將會導致CaSO4的轉換率下降,其原因是;保持溫度、反應時間、反應物和溶劑的量不變,實驗中提高CaSO4轉化率的操作有。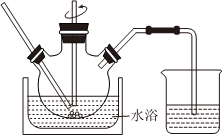
(4)濾渣水洗后,經多步處理得到制備輕質CaCO3所需的CaCl2溶液。設計以水洗后的濾渣為原料,制取CaCl2溶液的實驗方案:
①以下兩空為單選題:
用鹽酸溶解輕質CaCO3最適宜的操作為,待后過濾得濾渣2
A.在攪拌下向足量稀鹽酸中分批加入濾渣
B.在攪拌下向濾渣中分批加入足量稀鹽酸
C.觀察不到氣泡產生
D.固體全部溶解
濾渣2的主要成分為和。
②請補充后續操作:[已知pH=5時Fe(OH)3和Al(OH)3沉淀完全;pH=8.5時Al(OH)3開始溶解。實驗中必須使用的試劑:pH試紙和Ca(OH)2]。組卷:35引用:1難度:0.4


