蘇教版高二(下)高考題單元試卷:專題5 物質結構的探索無止境(01)
發布:2024/4/20 14:35:0
一、選擇題(共7小題)
-
1.如表為元素周期表的一部分,其中X、Y、Z、W為短周期元素,W元素原子的核電荷數為X元素的2倍。下列說法正確的是( )
X Y Z W T A.X、W、Z元素的原子半徑及它們的氣態氫化物的熱穩定性均依次遞增 B.Y、Z、W元素在自然界中均不能以游離態存在,它們的最高價氧化物的水化物的酸性依次遞增 C.YX2晶體熔化、液態WX3氣化均需克服分子間作用力 D.根據元素周期律,可以推測T元素的單質具有半導體特性,T2X3具有氧化性和還原性 組卷:3235引用:46難度:0.5 -
2.甲~庚等元素在周期表中的相對位置如圖,己的最高價氧化物對應水化物有強脫水性,甲和丁在同一周期,甲原子最外層與最內層具有相同電子數,下列判斷正確的是( )
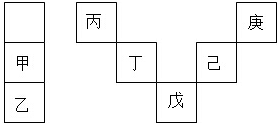
A.丙與戊的原子序數相差28 B.氣態氫化物的穩定性:庚<己<戊 C.常溫下,甲和乙的單質均能與水劇烈反應 D.丁的最高價氧化物可用于制造光導纖維 組卷:1954引用:23難度:0.7 -
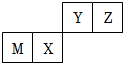 3.四種短周期元素在周期表中的位置如圖,其中只有M為金屬元素。下列說法不正確的是( )
3.四種短周期元素在周期表中的位置如圖,其中只有M為金屬元素。下列說法不正確的是( )A.原子半徑Z<M B.Y的最高價氧化物對應水化物的酸性比X的弱 C.X的最簡單氣態氫化物的熱穩定性比Z的小 D.Z位于元素周期表中第2周期第ⅥA族 組卷:526引用:76難度:0.9 -
4.短周期元素X、Y、Z、W的原子序數依次增大,且原子最外層電子數之和為13.X的原子半徑比Y的小,X與W同主族,Z是地殼中含量最高的元素。下列說法正確的是( )
A.原子半徑的大小順序:r(Y)>r(Z)>r(W) B.元素Z、W的簡單離子的電子層結構不同 C.元素Y的簡單氣態氫化物的熱穩定性比Z的強 D.只含X、Y、Z三種元素的化合物,可能是離子化合物,也可能是共價化合物 組卷:122引用:77難度:0.5 -
5.X、Y、Z、W是短周期元素,X元素原子的最外層未達到8電子穩定結構,工業上通過分離液態空氣獲得其單質;Y元素原子最外電子層上s、p電子數相等;Z元素+2價陽離子的核外電子排布與氖原子相同;W元素原子的M層有1個未成對的p電子.下列有關這些元素性質的說法一定正確的是( )
A.X元素的氫化物的水溶液顯堿性 B.Z元素的離子半徑大于 W 元素的離子半徑 C.Z元素的單質在一定條件下能與 X 元素的單質反應 D.Y元素最高價氧化物的晶體具有很高的熔點和沸點 組卷:53引用:48難度:0.7
三、解答題(共7小題)
-
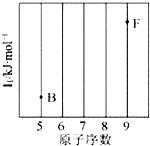 15.(1)依據第2周期元素第一電離能的變化規律,參照右圖B、F元素的位置,用小黑點標出C、N、O三種元素的相對位置.
15.(1)依據第2周期元素第一電離能的變化規律,參照右圖B、F元素的位置,用小黑點標出C、N、O三種元素的相對位置.
(2)NF3可由NH3和F2在Cu催化劑存在下反應直接得到:
2NH3+3F2NF3+3NH4FCu
①上述化學方程式中的5種物質所屬的晶體類型有(填序號).
a.離子晶體b.分子晶體c.原子晶體d.金屬晶體
②基態銅原子的核外電子排布式為.
(3)BF3與一定量水形成(H2O)2?BF3晶體Q,Q在一定條件下可轉化為R: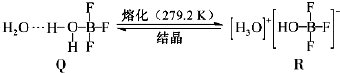
①晶體Q中各種微粒間的作用力不涉及(填序號).
a.離子鍵 b.共價鍵 c.配位鍵 d.金屬鍵 e.氫鍵 f.范德華力
②R中陽離子的空間構型為,陰離子的中心原子軌道采用雜化.
(4)已知苯酚(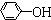 )具有弱酸性,其Ka=1.1×10-10;水楊酸第一級電離形成的離子
)具有弱酸性,其Ka=1.1×10-10;水楊酸第一級電離形成的離子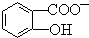 能形成分子內氫鍵.據此判斷,相同溫度下電離平衡常數Ka2(水楊酸)Ka(苯酚)(填“>”或“<”),其原因是.組卷:554引用:20難度:0.3
能形成分子內氫鍵.據此判斷,相同溫度下電離平衡常數Ka2(水楊酸)Ka(苯酚)(填“>”或“<”),其原因是.組卷:554引用:20難度:0.3 -
16.X,Z,Q,R,T,U分別代表原子序數依次增大的短周期元素;X和R屬同族元素,Z和U位于第ⅦA族;X和Z可形成化合物XZ4;Q基態原子的s軌道和P軌道的電子總數相等:T的一種單質在空氣中能夠自燃.
請回答下列問題:
(1)R基態原子的電子排布式是.
(2)利用價層電子對互斥理論判斷TU3的立體構型是.
(3)x所在周期元素最高價氧化物對應的水化物中.酸性最強的是(填化學式);Z和U的氫化物中沸點較高的是(填化學式);Q,R,U的單質形成的晶體,熔點由高到低的排列順序是(填化學式)
(4)CuSO4溶液能用作T4中毒的解毒劑,反應可生成T的最高價含氧酸和銅,該反應的化學方程式是.組卷:1068引用:21難度:0.5


