2020-2021學年浙江省臺州市黃巖區東浦中學九年級(上)第一次段考試卷
發布:2024/4/20 14:35:0
一、選擇題
-
1.下列變化中,屬于物理變化的是( )
A. 
煤礦自燃B. 
植物進行光合作用C. 
鐵絲變形D. 
氯化鐵溶液中加硫氰化鉀溶液組卷:22引用:6難度:0.9 -
2.下列燒杯中盛裝的溶液屬于酸溶液的是( )
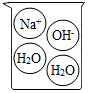
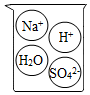
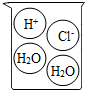
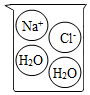
A B C D A.A B.B C.C D.D 組卷:14引用:2難度:0.4 -
3.芋艿(俗稱毛芋)是一種常見的食品,新鮮芋艿在去皮時會出現一種白色的汁液,汁液內含有一種堿性物質-皂角甙,沾上它會奇癢難忍,下列廚房中的物質止癢效果最好的是( )
A.食醋 B.料酒 C.純堿 D.食鹽水 組卷:728引用:32難度:0.7 -
4.在一定質量的NaOH溶液中逐滴加入蒸餾水,如圖中能正確表示溶液pH變化的是(橫坐標表示加入蒸餾水的質量,縱坐標表示溶液的pH)( )
A. 
B. 
C. 
D.  組卷:421引用:8難度:0.9
組卷:421引用:8難度:0.9 -
5.粗心的小輝在做完實驗后,將下列物質敞口放置,一段時間后,質量增加且變質的是( )
A.固體氫氧化鈉 B.濃鹽酸 C.濃硫酸 D.食鹽 組卷:21引用:3難度:0.6 -
6.下列各組離子在溶液中能大量共存的是( )
A.K+、SO42-、NO3- B.NH4+、OH-、Cl- C.Cu2+、Na+、OH- D.Ca2+、K+、CO32- 組卷:358引用:8難度:0.6 -
7.下列各種物質的名稱或俗稱和化學式表示的是同一種物質的是( )
A.生石灰,大理石,CaCO3 B.火堿,純堿,NaOH C.鐵銹,氫氧化鐵,Fe(OH)3 D.熟石灰,消石灰,Ca(OH)2 組卷:15引用:3難度:0.9 -
8.下列反應屬于復分解反應的是( )
A.Ca+H2O═Ca(OH)2 B.2H2O2 2H2O+O2↑MnO2C.Na2CO3+Ca(OH)2═CaCO3↓+2NaOH D.Zn+H2SO4═ZnSO4+H2↑ 組卷:35引用:3難度:0.8 -
9.人體內幾種液體的正常pH范圍如下:下列說法錯誤的是( )
體液 血漿 胃液 膽汁 胰液 pH 7.35~7.45 0.9~1.5 7.1~7.3 7.5~8.0 A.血漿呈堿性 B.胃液和膽汁呈酸性 C.胰液比血漿的堿性強 D.胃酸過多的人應少飲碳酸飲料 組卷:295引用:23難度:0.7 -
10.現有4種試劑:①紫色石蕊試液;②稀硫酸;③碳酸鉀溶液;④氯化鋇溶液。能用來一次性鑒別稀鹽酸、氫氧化鋇溶液、碳酸鈉溶液的試劑有( )
A.② B.②③ C.①②③ D.②③④ 組卷:785引用:27難度:0.7 -
11.如圖是氫氧化鈉溶液與稀鹽酸恰好完全反應的微觀示意圖,下列結論正確的是( )
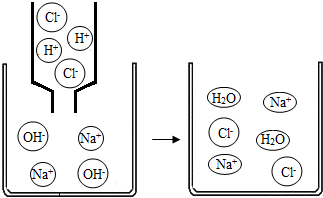
A.反應后溶液的pH大于7 B.反應前后原子種類發生了變化 C.反應后溶液中存在的粒子只有Na+和Cl- D.兩種溶液混合時,氫離子與氫氧根離子結合生成了水 組卷:34引用:2難度:0.6
四、解答題(本題有6小題,第30題8分,第31題10分,第32題6分,第33題14分,第34題7分,第35題10分,共55分)
-
34.復合墻紙是室內裝飾的常用材料,含大量碳酸鈣,有低碳環保的優勢。為測定復合墻紙中碳酸鈣的含量,某同學稱取50克復合墻紙樣品,平均分成5份,分別加入溶質質量分數相同、質量不同的稀鹽酸中進行實驗(化學方程式為CaCO3+2HCl═CaCl2+H2O+CO2↑),實驗數據如表。
(假設墻紙中的其它成分既不溶于水,也不與稀鹽酸反應)
(1)根據實驗數據判斷鹽酸過量的組別是:組別 ① ② ③ ④ ⑤ 加入樣品的質量/克 10 10 10 10 10 加入稀鹽酸的質量/克 10 20 30 40 50 充分反應后生成氣體的質量/克 0.44 0.88 1.32 1.54 1.54 。
(2)根據化學方程式列式計算該樣品中碳酸鈣的質量分數。
(3)該稀鹽酸中氯元素的質量分數為。組卷:91引用:2難度:0.5 -
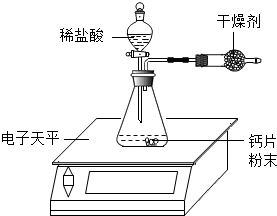 35.小明為了測定某鈣片中碳酸鈣的質量分數,用如圖裝置進行如下實驗:
35.小明為了測定某鈣片中碳酸鈣的質量分數,用如圖裝置進行如下實驗:
①取研碎后的鈣片4克,導入氣密性良好的錐形瓶中,然后在分液漏斗中加入適量的稀鹽酸,置于電子天平上測出裝置總質量。
②打開活塞,滴入足量稀鹽酸后關閉活塞,待氣泡不再冒出時,測出反應后裝置總質量。
③整理相關數據如表所示,計算出鈣片中碳酸鈣的質量分數。
1)該實驗中,對裝置中的固態干燥劑的性質有何要求?反應前總質量(克) 275.58 反應后總質量(克) 274.92 反應前后總質量差(克) 0.66 容器內氣體質量差(克) m
(2)反應前容器內是空氣(密度為ρ1),反應后全部是二氧化碳(密度為ρ2),則反應前后容器(容積為V)內的氣體質量差為m為。(用字母表示,反應物的體積忽略不計)
(3)小明查閱有關數據后,計算出反應前后容器內的氣體質量差m為0.22克,結合表中數據,計算該鈣片中碳酸鈣的質量分數。(CaCO3+2HCl=CaCl2+H2O+CO2↑)。鈣片中的其它成分不與鹽酸反應。組卷:1009引用:53難度:0.5


