2018-2019學年黑龍江省大慶實驗中學高二(上)開學化學試卷
發布:2024/4/20 14:35:0
一、解答題(共12小題,滿分24分)
-
1.碘元素的一種核素
可用于治療腫瘤.下列有關12553I的說法正確的是( )12553IA.質量數是53 B.質子數是125 C.中子數是125 D.電子數是53 組卷:67引用:5難度:0.5 -
2.下列說法中正確的是( )
A.PM 2.5、二氧化碳都屬于空氣質量日報的內容 B.向煤中加入適量CaSO4,可大大減少燃燒產物中SO2的量 C.對“地溝油”進行分餾可得到汽油 D.“光化學煙霧”、“硝酸型酸雨”的形成都與氮氧化合物有關 組卷:39引用:7難度:0.9 -
3.家用84消毒液的有效成分是( )
A.NaClO B.NaCl C.Ca(ClO)2 D.HClO 組卷:18引用:2難度:0.7 -
4.設NA為阿伏加德羅常數的值,下列有關敘述正確的是( )
A.標準狀況下,22.4L四氯化碳中含有C-Cl數目為4NA B.1mol Cl2通入足量水中反應轉移的電子數為NA C.常溫下,0.5mol?L-1Fe2(SO4)3溶液中含Fe3+數目為NA D.常溫常壓下,5.6g丙烯和環丙烷的混合氣體中含有的碳原子數為0.4NA 組卷:14引用:2難度:0.7 -
5.某學生進行蔗糖的水解實驗,并檢驗水解產物中是否含有葡萄糖.他的操作如下:取少量純蔗糖加水配成溶液;在蔗糖溶液中加入3~5滴稀硫酸;將混合液煮沸幾分鐘、冷卻;在冷卻后的溶液中加入銀氨,在水浴中加熱.實驗結果沒有銀鏡產生.其原因是( )
A.蔗糖尚未水解 B.蔗糖水解的產物中沒有葡萄糖 C.加熱時間不夠 D.煮沸后的溶液中沒有加堿,以中和作催化劑的酸 組卷:635引用:27難度:0.9 -
6.分子式為C5H12O并能與金屬鈉反應放出氫氣的有機化合物有( )
A.6種 B.7種 C.8種 D.9種 組卷:175引用:12難度:0.7 -
7.下列物質既能由金屬和酸反應獲得,也能通過金屬和氯氣反應獲得的是( )
A.CuCl2 B.FeCl2 C.FeCl3 D.AlCl3 組卷:103引用:9難度:0.7 -
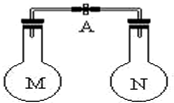 8.室溫時,兩個容積相同的燒瓶中分別盛有M和N兩種氣體(同溫同壓),取下彈簧夾A,使兩燒瓶內的氣體接觸(如圖),容器內的壓強由大到小的順序是( )
8.室溫時,兩個容積相同的燒瓶中分別盛有M和N兩種氣體(同溫同壓),取下彈簧夾A,使兩燒瓶內的氣體接觸(如圖),容器內的壓強由大到小的順序是( )編號 ① ② ③ ④ 氣體M HI NH3 H2 NO 氣體N Cl2 HCl N2 O2 A.①②③④ B.③①④② C.④①②③ D.①④③② 組卷:46引用:8難度:0.9
三、解答題(共5小題,滿分1分)
-
23.某課題組為了深入探究二氧化硫的性質設計以下裝置進行了實驗。
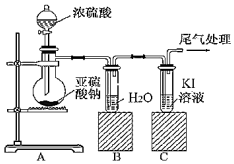
步驟一:檢驗裝置氣密性后向B、C中各加入20mL圖示液體。
步驟二:打開A中活塞,反應進行10分鐘后關閉活塞。
步驟三:用pH計分別測量B、C試管中溶液的pH。
結合上述實驗,回答以下問題:
請回答下列問題:
(1)裝置A中盛放亞硫酸鈉的儀器名稱是,其中發生反應的化學方程式為。
(2)甲同學認為兩瓶中pH大致相等,原因是二氧化硫溶于水后生成了酸性物質,該物質發生電離所致。
(3)通過pH計測定,B瓶中pH為2.13,C瓶中pH為1.05.為了解釋該實驗現象,該同學提出進行多次平行實驗,目的是。
測定結果如下:
實驗發現:C瓶中溶液的酸性始終比B瓶中的酸性強。第1次實驗 第2次實驗 第3次實驗 B瓶中pH 2.15 2.10 2.17 C瓶中pH 1.10 1.12 1.09
(4)通過查閱文獻,I-可以作為水溶液中SO2歧化反應的催化劑,可能的催化過程分兩步進行如下,將ii補充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+═++2I-
(5)最終結論:C瓶中溶液酸性強于B瓶,是由于生成了,該過程中體現出二氧化硫哪些化學性質(選填“氧化性”,“還原性”)。組卷:3引用:1難度:0.6 -
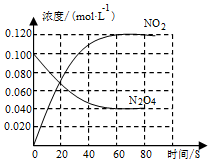 24.在容積為1.00L的容器中,通入一定量的N2O4,發生反應N2O4(g)?2NO2(g),隨溫度的升高,混合氣體的顏色變深。回答下列問題:
24.在容積為1.00L的容器中,通入一定量的N2O4,發生反應N2O4(g)?2NO2(g),隨溫度的升高,混合氣體的顏色變深。回答下列問題:
(1)反應的△H0(填“大于”或“小于”);100℃時,體系中各物質濃度隨時間變化如圖所示。在0~60s時段,反應速率v(N2O4)為mol?L-1?s-1。
(2)100℃時達平衡后,改變反應溫度為T,c(N2O4)以0.0020mol?L-1?s-1的平均速率降低,經10s又達到平衡。T100℃(填“大于”或“小于”),判斷理由是。
(3)溫度T時反應達平衡后,將反應容器的容積減少一半,平衡向(填“正反應”或“逆反應”)方向移動。
(4)在2NO2?N2O4的可逆反應中,下列狀態一定屬于平衡狀態的是()
A.N2O4和NO2的分子數比為1:2 B.N2O4和NO2的濃度相等
C.平衡體系的顏色一定不再改變D.單位時間有1molN2O4變為NO2的同時,有2molNO2變為N2O4組卷:24引用:2難度:0.5


