2021-2022學年山東省煙臺市高二(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題:本題共10小題,每小題2分,共20分。每小題只有一個選項符合題目要求。
-
1.下列說法正確的是( )
A.液晶的光學性質隨外加電場的變化而變化 B.超分子是由兩個或多個分子通過共價鍵形成的分子聚集體 C.按照現有構造原理,理論上元素周期表第八周期應有32種元素 D.玻爾理論不僅成功解釋了氫原子光譜,而且還推廣到其他原子光譜 組卷:73引用:2難度:0.9 -
2.下列說法錯誤的是( )
A.基態原子的p能級上半充滿的元素一定位于p區 B.核外電子排布相同的兩原子,一定屬于同種元素 C.基態原子的價電子排布為(n-1)dxnsy的元素,族序數一定為x+y D.基態原子的N層上只有一個電子的元素,不一定是第ⅠA族元素 組卷:34引用:2難度:0.6 -
3.下列軌道表示式正確且所表示的元素原子的能量處于最低狀態的是( )
A. 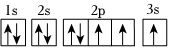
B. 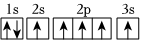
C. 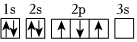
D. 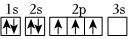 組卷:151引用:2難度:0.7
組卷:151引用:2難度:0.7 -
4.現有四種元素的基態原子的核外電子排布式:①1s22s22p3;②1s22s22p4;③1s22s22p63s23p2;④1s22s22p63s23p3。下列說法錯誤的是( )
A.電負性:②>①>④>③ B.原子半徑:③>④>①>② C.第一電離能:②>①>④>③ D.簡單氣態氫化物的穩定性:②>①>④>③ 組卷:31引用:1難度:0.7 -
5.下列關于分子性質的解釋錯誤的是( )
A.H2O很穩定,因為水分子之間存在氫鍵 B.I2易溶于苯、CH4難溶于水,都可用“相似相溶”原理解釋 C.HClO3酸性強于HClO,因為HClO3分子中非羥基氧原子數多 D.乳酸[CH3CH(OH)COOH]有一對對映異構體,因為其分子中含有一個手性碳原子 組卷:67引用:4難度:0.7 -
6.關于價電子對互斥理論說法錯誤的是( )
A.分子中價電子對相互排斥決定了分子的空間結構 B.分子中鍵角越大,價電子對相互排斥力越小,分子越穩定 C.用該理論預測H2S和BF3的空間結構為角形和平面三角形 D.該理論一定能預測出多中心原子的分子、離子或原子團的空間構型 組卷:31引用:3難度:0.7
三、非選擇題:本題共5小題,共60分。
-
19.LiFePO4、LiPF6原材料豐富,對環境污染性較少、安全穩定,是鋰離子電池理想的正極材料和電解液。回答下列問題:
(1)HF、HCl、HBr的酸性由強到弱的順序為(填化學式,下同);沸點由高到低的順序為;還原性由強到弱的順序為。
(2)Li2O為立方晶系晶體,離子位置按圖示坐標系為:Li+:(0.25,0.25,0.25);(0.25,0.75,0.25);(0.75,0.25,0.25);(0.75,0.75,0.25);…O2-:(0,0,0);(0.5,0.5,0);(0.5,0,0.5);(0,0.5,0.5);…則Li2O晶胞沿z軸投影的俯視圖(其中“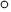 ”表示Li+,“
”表示Li+,“ ”表示O2-)為 。
”表示O2-)為 。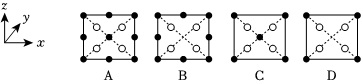
(3)亞磷酸(H3PO3)中心原子磷的配位數為4,則亞磷酸為元酸。磷酸通過分子間脫水縮合形成多磷酸,如圖: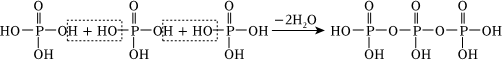
如果有n個磷酸分子間脫水形成環狀的多磷酸,則該環狀的多磷酸的化學式為。
(4)一種鐵基超導化合物的晶胞結構如圖,則該超導化合物的化學式為。
已知晶胞邊長為xpm,高為ypm,α=β=γ=90°,化合物的摩爾質量為Mg?mol-1,設NA為阿伏加德羅常數的值,則該晶體的密度為g?cm-3(用代數式表示)。以晶胞參數為單位長度建立的坐標系可以表示晶胞中各原子的位置,稱為原子的分數坐標。該晶胞中,1號Fe原子的分數坐標為(0,,12),3號In原子的分數坐標為(0,14,12),則2號S原子的分數坐標為34。組卷:16引用:1難度:0.4 -
20.鐵銅在人類生產和生活中有重要作用。回答下列問題:
(1)基態Fe原子的價層電子排布式為,第四周期元素的基態原子中,未成對電子數與基態銅原子相同且位于p區的元素有(填元素符號)。
(2)CuSO4溶于過量氨水可以制取離子化合物[Cu(NH3)4(H2O)2]SO4,該化合物中Cu2+的配位數為,化合物加熱時首先失去的組分是,判斷理由是。
(3)Fe3+可與H2O形成配離子[Fe(H2O)6]3+,[Fe(H2O)6]3+為淺紫色。將Fe(NO3)3?9H2O固體溶解,溶液卻呈黃色,其原因是,為了能觀察到溶液中[Fe(H2O)6]3+的淺紫色,可采取的方法是。
(4)如圖為金屬鐵的一種面心立方晶胞結構示意圖,已知鐵原子半徑為rcm,則該晶胞參數a=cm。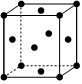
由于晶體缺陷造成晶體結構中部分原子缺失,缺陷率為單位體積內缺失原子數占應有原子總數的百分比。實際測得該晶體密度為5.60g?cm-3,設阿伏加德羅常數的值為NA,則晶胞的缺陷率為(用代數式表示)。組卷:20引用:2難度:0.5


