2021-2022學年江蘇省蘇州市高三(上)期初化學試卷
發布:2024/4/20 14:35:0
一、單項選擇題:本題共14小題,每小題3分,共42分。每題只有一個選項最符合題意。
-
1.“碳中和”是指CO2的排放總量和減少總量相當。下列措施中能促進“碳中和”最直接有效的是( )
A.推行生活垃圾分類 B.大規模開采可燃冰作為新能源 C.安裝脫硫設備減少煤燃燒污染 D.研發催化劑將CO2還原為甲醇 組卷:13引用:4難度:0.6 -
2.氨硼烷(NH3?BH3)是一種固體儲氫材料,其結構和乙烷相似,下列有關說法正確的是( )
A.中子數為8的N原子: N87B.基態B原子的外圍電子排布式:2s22p3 C.NH3?BH3分子中N-B鍵是配位鍵 D.NH3?BH3分子中所有原子共平面 組卷:26引用:3難度:0.6 -
3.下列鹽的性質與用途具有對應關系的是( )
A.NH4Cl溶液呈酸性,可用于除鐵銹 B.NaHCO3受熱易分解,可用于治療胃酸 C.K2FeO4易溶于水,可用于殺菌消毒 D.Na2SO3溶液呈堿性,可用于污水脫氯(Cl2) 組卷:12引用:2難度:0.7 -
4.2021年6月17日,搭載神舟十二號載人飛船的長征二號F遙十二運載火箭成功發射,并順利完成與天和核心艙對接。火箭采用偏二甲肼/四氧化二氮發動機,核心艙電源系統由鋰離子蓄電池組及太陽電池翼組成。飛船逃逸系統發動機噴管擴散段采用了酚醛樹脂與增強體復合新工藝,氮化硼陶瓷基復合材料應用于核心艙電推進系統,碳化硅顆粒增強鋁基復合材料應用于太陽電池翼伸展機構關鍵部件,表面處理后鎂合金部件應用在核心艙醫學樣本分析與高微重力科學實驗柜中。材料領域的發展助力航天。下列有關說法正確的是( )
A.氮化硼、碳化硅陶瓷屬于傳統無機非金屬材料 B.鎂合金能夠滿足減重、耐蝕、導電等多功能要求 C.太陽電池翼將太陽能轉化為電能,其主要成分為SiO2 D.飛船逃逸系統復合材料中的酚醛樹脂由加聚反應獲得 組卷:10引用:3難度:0.8 -
5.2021年6月17日,搭載神舟十二號載人飛船的長征二號F遙十二運載火箭成功發射,并順利完成與天和核心艙對接。火箭采用偏二甲肼/四氧化二氮發動機,核心艙電源系統由鋰離子蓄電池組及太陽電池翼組成。飛船逃逸系統發動機噴管擴散段采用了酚醛樹脂與增強體復合新工藝,氮化硼陶瓷基復合材料應用于核心艙電推進系統,碳化硅顆粒增強鋁基復合材料應用于太陽電池翼伸展機構關鍵部件,表面處理后鎂合金部件應用在核心艙醫學樣本分析與高微重力科學實驗柜中。長征二號F遙十二運載火箭發動機發生的反應為:C2H8N2(g)+2N2O4(g)
2CO2(g)+4H2O(g)+3N2(g)。下列有關說法正確的是( )點燃A.偏二甲肼的結構簡式為(CH3)2N=NH2 B.N2O4在反應中作還原劑 C.該反應的ΔH<0、ΔS<0 D.用E總表示鍵能之和,該反應ΔH=E總(反應物)-E總(生成物) 組卷:8引用:2難度:0.7 -
6.2021年6月17日,搭載神舟十二號載人飛船的長征二號F遙十二運載火箭成功發射,并順利完成與天和核心艙對接。火箭采用偏二甲肼/四氧化二氮發動機,核心艙電源系統由鋰離子蓄電池組及太陽電池翼組成。飛船逃逸系統發動機噴管擴散段采用了酚醛樹脂與增強體復合新工藝,氮化硼陶瓷基復合材料應用于核心艙電推進系統,碳化硅顆粒增強鋁基復合材料應用于太陽電池翼伸展機構關鍵部件,表面處理后鎂合金部件應用在核心艙醫學樣本分析與高微重力科學實驗柜中。鋰離子蓄電池放電時的反應如下:Li1-xCoO2+LixC6═LiCoO2+C6(x<1)。下列說法正確的是( )
A.Co3+的基態3d能級上有2個未成對電子 B.該電池比能量高,污染小,是理想的一次電池 C.充電時,陰極電極反應式為:xLi++C6+xe-═LixC6 D.放電時,Li+在電解質中由正極向負極遷移 組卷:13引用:3難度:0.5
二、非選擇題共58分
-
17.焦亞硫酸鈉(Na2S2O5)常用作葡萄酒、果脯等食品的抗氧化劑。
Ⅰ.焦亞硫酸鈉的制備
已知:①Na2S2O5在空氣中、受熱時均易分解。
②生成Na2S2O5的化學方程式為2NaHSO3═Na2S2O5+H2O。
③水溶液中H2SO3、HSO3-、SO32-的物質的量分數隨pH的分布如圖1所示。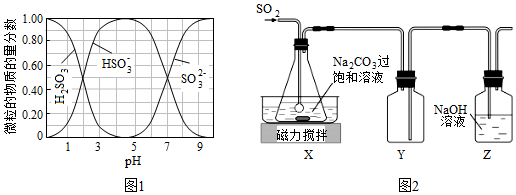
(1)SO2與Na2CO3過飽和溶液反應生成NaHSO3和CO2,其離子方程式為。
(2)實驗室制備少量Na2S2O5的裝置如圖2所示,請補充完整相應實驗方案:在不斷攪拌下,控制反應溫度在40℃左右。20℃靜置結晶,經減壓抽濾、洗滌、25~30℃干燥,可獲得Na2S2O5固體。
(3)裝置Y的作用是;實驗制得的Na2S2O5固體中含有一定量的Na2SO4,其原因是
Ⅱ.焦亞硫酸鈉含量的測定工業焦亞硫酸鈉優質品要求質量分數≥96.5%。通過下列實驗檢測焦亞硫酸鈉樣品是否達到優質品標準。實驗檢測原理為:Na2S2O5+CH3COOH+I2+H2O═H2SO4+HI+CH3COONa(未配平),I2+2Na2S2O3═Na2S4O6+2NaI。準確稱取0.1950g樣品,快速置于預先加入30.00mL 0.1000mol?L-1碘標準液及20mL水的250mL碘量瓶中,加入5mL乙酸溶液,立即蓋上瓶塞,水封,緩緩搖動溶解后,置于暗處放置5min;用0.1000mol?L-1Na2S2O3標準溶液滴定至溶液呈微黃色,加入淀粉指示劑,繼續滴定至終點,消耗Na2S2O3溶液20.00mL。
(4)滴定終點現象是。
(5)通過計算判斷該樣品是否為優質品。(寫出計算過程)。組卷:19引用:3難度:0.6 -
18.硝基苯是一種具有穩定化學性質、高毒性、難生物降解的污染物。工業上采用吸附、還原、氧化等方法可有效降解廢水中的硝基苯。
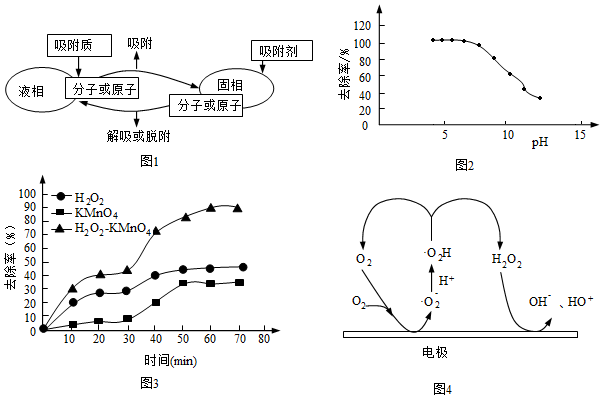
(1)活性炭因為有較大的比表面積、多孔結構而具有較強的吸附能力,其物理吸附平衡建立如圖1所示。活性炭處理低濃度的硝基苯廢水時,當溫度超過50℃,活性炭對硝基苯的吸附量顯著下降,原因是(請從平衡移動角度解釋)。
(2)鐵炭混合物中極小顆粒的炭分散在鐵屑內,具有吸附作用,同時作正極材料構成原電池加快反應速率,還能防止鐵屑結塊。
①酸性環境中,鐵炭混合物處理硝基苯廢水,難生物降解的硝基苯首先被還原為亞硝基苯( ),然后進一步被還原成可生物降解的苯胺,寫出生成亞硝基苯的電極反應式:。
),然后進一步被還原成可生物降解的苯胺,寫出生成亞硝基苯的電極反應式:。
②硝基苯的降解率隨pH變化如圖2所示。pH為4時,降解率達100%,pH為10時,降到50%左右。在堿性條件下,隨著pH升高,降解率降低的原因是。
(3)研究發現,H2O2在Fe2+、Mn2+等離子作用下能夠生成羥基自由基(HO)。HO具有很強的氧化作用,是氧化硝基苯的有效因子。H2O2、KMnO4作為強氧化劑,也可以與硝基苯直接發生氧化降解反應。
①相同條件下,三種氧化劑降解硝基苯的去除率如圖3,則該條件下最佳的氧化劑是(填化學式)。
②向含有Fe2+的酸性溶液中滴加H2O2,寫出生成HO的離子反應方程式:。
③通過電激發也可以產生HO,可能的機理如圖4,產生過程可描述為。組卷:36引用:3難度:0.6


