2019-2020學(xué)年福建省莆田一中高二(下)期中化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題(本題共21個小題,每小題2分。在每小題給出的四個選項中,只有一項是符合題目要求的。)
-
1.下列各組表述中,兩個微粒一定不屬于同種元素原子的是( )
A.3p能級有一個空軌道的基態(tài)原子和核外電子排布為1s22s22p63s23p2的原子 B.M層全充滿而N層為4s2的原子和核外電子排布為1s22s22p63s23p63d64s2的原子 C.最外層電子數(shù)是核外電子總數(shù)的 的原子和價電子排布為4s24p5的原子15D.2p能級有一個未成對電子的基態(tài)原子和原子的價電子排布為2s22p5的原子 組卷:270引用:31難度:0.7 -
2.下列有關(guān)電子排布圖的表述正確的是( )
A.  可表示單核10電子粒子基態(tài)時電子排布
可表示單核10電子粒子基態(tài)時電子排布B.  此圖錯誤,違背了泡利原理
此圖錯誤,違背了泡利原理C.  表示基態(tài)N原子的價電子排布
表示基態(tài)N原子的價電子排布D.  表示處于激發(fā)態(tài)的B的電子排布圖組卷:130引用:12難度:0.9
表示處于激發(fā)態(tài)的B的電子排布圖組卷:130引用:12難度:0.9 -
3.下表列出了某短周期元素R的各級電離能數(shù)據(jù)(用I1、I2…表示,單位為kJ?mol-1)。下列關(guān)于元素R的判斷中一定正確的是( )
①R的最高正價為+3價I1 I2 I3 I4 … R 740 1 500 7 700 10 500
②R元素位于元素周期表中第ⅡA族
③R元素第一電離能大于同周期相鄰元素
④R元素基態(tài)原子的電子排布式為1s22s2。A.①② B.②③ C.③④ D.①④ 組卷:370引用:19難度:0.7 -
4.下列說法中不正確的是( )
A.N2O與CO2、CCl3F與CCl2F2互為等電子體 B.CCl2F2無同分異構(gòu)體,說明碳原子采用sp3雜化 C.同種元素的含氧酸,該元素的化合價越高,含氧酸的酸性就越強(qiáng),氧化性越強(qiáng) D.由第ⅠA族和第ⅥA族元素形成的原子個數(shù)比為2:1、電子總數(shù)為30的化合物,是離子化合物 組卷:7引用:1難度:0.6 -
5.以下有關(guān)元素性質(zhì)的說法不正確的是( )
A.具有下列電子排布式的原子中:①1s22s22p63s23p2,②1s22s22p3,③1s22s22p2,④1s22s22p63s23p4,原子半徑最大的是① B.具有下列價電子排布式的原子中:①3s23p1,②3s23p2,③3s23p3,④3s23p4,第一電離能最大的是③ C.①Na、K、Rb,②N、P、As,③O、S、Se,④Na、P、Cl中,元素的電負(fù)性隨原子序數(shù)增大而遞增的是④ D.電子構(gòu)型為[Xe]4f145d76s2的元素位于周期表中的f區(qū) 組卷:10引用:2難度:0.7 -
6.Co(+3價)的八面體配合物為CoClm?nNH3,若1mol該配合物與AgNO3作用生成1molAgCl沉淀,則m、n的值是( )
A.m=1,n=5 B.m=3,n=4 C.m=5,n=1 D.m=4,n=5 組卷:77引用:13難度:0.9 -
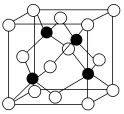 7.冰晶胞中水分子的空間排列方式與金剛石晶胞(其晶胞結(jié)構(gòu)如圖,其中空心球所示原子位于立方體的頂點(diǎn)及面心,實(shí)心球所示原子位于立方體內(nèi))類似。有關(guān)冰晶胞的說法合理的是( )
7.冰晶胞中水分子的空間排列方式與金剛石晶胞(其晶胞結(jié)構(gòu)如圖,其中空心球所示原子位于立方體的頂點(diǎn)及面心,實(shí)心球所示原子位于立方體內(nèi))類似。有關(guān)冰晶胞的說法合理的是( )A.冰晶胞內(nèi)水分子間以共價鍵相結(jié)合 B.晶體冰與金剛石晶體硬度都很大 C.冰分子間的氫鍵具有方向性和飽和性,也是一種σ鍵 D.氫鍵的存在導(dǎo)致冰晶胞與金剛石晶胞微粒的排列方式類似 組卷:27引用:7難度:0.6 -
8.下列敘述錯誤的是( )
①離子鍵沒有方向性和飽和性,而共價鍵有方向性和飽和性
②配位鍵在形成時,是由成鍵雙方各提供一個電子形成共用電子對
③金屬鍵的實(shí)質(zhì)是金屬中的“自由電子”與金屬陽離子形成的一種強(qiáng)烈的相互作用
④在冰晶體中,既有極性鍵、非極性鍵,又有氫鍵
⑤化合物NH4Cl和CuSO4?5H2O都存在配位鍵
⑥NaCl、HF、CH3CH2OH、SO2都易溶于水,但原因不完全相同.A.①③ B.②④ C.②⑤ D.④⑥ 組卷:174引用:20難度:0.9
二、非選擇題(本題共5小題,共58分)
-
25.碳族元素的單質(zhì)及其化合物是一類重要物質(zhì)。請回答下列問題:
(1)鍺(Ge)是用途很廣的半導(dǎo)體材料,基態(tài)Ge原子的核外電子中,有個未成對電子。
(2)Ge與C是同族元素,C原子之間可以形成雙鍵、三鍵,但Ge原子之間難以形成雙鍵或三鍵。從原子結(jié)構(gòu)角度分析,原因是。
(3)GeCl4可水解生成一種氧化物和一種無氧酸,其化學(xué)反應(yīng)方程式為:。
(4)光催化還原CO2制備CH4反應(yīng)中,帶狀納米Zn2GeO4是該反應(yīng)的良好催化劑。Zn、Ge、O電負(fù)性由大至小的順序是。
(5)Ge單晶具有金剛石型結(jié)構(gòu),其中Ge原子的雜化方式為,微粒之間存在的作用力是。
(6)合成氮化碳是一種硬度比金剛石還大的晶體,氮化碳的晶體類型為,該晶體中微粒間的作用力是。
(7)COCl2俗稱光氣,分子中C原子采取sp2雜化成鍵,光氣分子的結(jié)構(gòu)式為,其中碳氧原子之間共價鍵是(填序號)。
a.2個σ鍵
b.2個π鍵
c.1個σ鍵,1個π鍵
(8)CaC2中C22-與O22+互為等電子體,O22+的電子式可表示為。組卷:9引用:1難度:0.7 -
26.第四周期中的18中元素具有重要的用途,在現(xiàn)代工業(yè)中備受青睞.
(1)鉻是一種硬二脆,抗腐蝕性強(qiáng)的金屬,常用于電鍍和制造特種鋼.基態(tài)Cr原子中,電子占據(jù)最高能層的符號為,該能層上具有的原子軌道數(shù)為,電子數(shù)為,
(2)第四周期元素的第一電離能隨原子序數(shù)的增大,總趨勢是逐漸增大的,30Zn與31Ga的第一電離能是否符合這一規(guī)律?(填“是”或“否”),原因是(如果前一問填“是”,此問可以不答)
(3)鎵與第VA族元素可形成多種新型人工半導(dǎo)體材料,砷化鎵(GaAs)就是其中一種,其晶體結(jié)構(gòu)如下圖所示(白色球代表As原子).在GaAs晶體中,每個Ga原子與個As原子相連,與同一個Ga原子相連的As原子構(gòu)成的空間構(gòu)型為;
(4)與As同主族的短周期元素是N、P.AsH3中心原子雜化的類型;一定壓強(qiáng)下將AsH3和NH3.PH3的混合氣體降溫是首先液化的是,理由是;
(5)鐵的多種化合物均為磁性材料,氮化鐵石期中一種,某氮化鐵的晶胞結(jié)構(gòu)如圖所示,則氮化鐵的化學(xué)式為;設(shè)晶胞邊長為acm,阿伏加德羅常數(shù)為NA,該晶體的密度為g.jye.ai-3(用含a和NA的式子表示) 組卷:35引用:3難度:0.3
組卷:35引用:3難度:0.3


