2013-2014學年江西省南昌市新建二中實驗班高三(上)周練化學試卷(十四)
發布:2024/4/20 14:35:0
一、選擇題(本題包括16小題,每小題3分,共48分,每小題只有一個選項符合題意)
-
1.下列有關化學與生活、工業的敘述中,不正確的是( )
A.工業生產玻璃、水泥、漂白粉,均需要用石灰石為原料 B.CO會與血紅蛋白結合,使人中毒;可將中毒病人放入氧倉中解毒,其解毒原理符合平衡移動原理 C.2011年5月份起,面粉中禁止添加CaO2、過氧化苯甲酰等增白劑,CaO2屬于堿性氧化物 D.固體煤經處理變為氣體燃料后,可以減少SO2和煙塵的排放,且燃燒效率提高,有利于“節能減排” 組卷:32引用:1難度:0.9 -
2.下列判斷中,正確的是( )
A.AlCl3溶液和Al2(SO4)3溶液加熱蒸干,灼燒都得到Al2O3 B.25℃時,Mg(OH)2固體在蒸餾水、鹽酸和氯化銨溶液中的Ksp大小順序為:鹽酸>氯化銨>蒸餾水 C.已知25℃時,NH4F溶液顯酸性,則電離常數K(NH3?H2O)<K(HF) D.向NH4HSO4溶液中滴加NaOH溶液至中性,所得混合溶液中,c(Na+)>c( )>c(NH+4)>c(OH-)=c(H+)SO2-4組卷:43引用:1難度:0.9 -
3.已知:N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol,相關數據如下
一定條件下,在體積為1L的密閉容器中加入1molN2和3molH2充分反應,放出熱量Q1kJ,下列說法正確的是( )H2(g) N2(g) NH3(g) 1mol分子中的化學鍵形成時要釋放出的能量/kJ 436 946 a A.如圖可表示合成氨過程中的能量變化 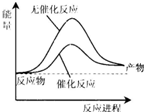
B.a的數值為391 C.Q1的數值為92 D.相同條件下,反應物若為2molN2和6molH2,放出熱量Q2>2Q1 組卷:19引用:6難度:0.9 -
4.下列有關說法中,不正確的是( )
A.在0.1mol/L的 Na2SO3溶液中加入少量NaOH固體,c( )與c(Na+)均增大SO2-3B.常溫下,CH3COONa溶液的pH=8,則c(Na+)-c(CH3COO-)=9.9×10-7mol/L C.常溫下,0.1mol/L的某酸溶液中,若c(OH-)/c(H+)=1×10-8,則溶液中由水電離出的c(H+)=1×10-11mol/L D.a mol/L的 HCN溶液與b mol/L 的NaOH溶液等體積混合,所得溶液中c(Na+)>c(CN-),則a一定小于b 組卷:51引用:2難度:0.9 -
5.在恒溫恒壓下,向密閉容器中充入4mol SO2和2mol O2,發生如下反應:2SO2+O2?2SO3△H<0.2min后,反應達到平衡,生成SO3為1.4mol,同時放出熱量Q kJ.則下列分析正確的是( )
A.在該條件下,反應前后的壓強之比為6:5.3 B.若反應開始時容器體積為2L,則v(SO3)=0.35mol/(L?min) C.若把“恒溫恒壓下”改為“恒壓絕熱條件下”反應,平衡后n(SO3)<1.4mol D.若把“恒溫恒壓下”改為“恒溫恒容下”反應,達平衡時放出熱量大于Q kJ 組卷:64引用:6難度:0.7 -
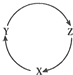 6.下列各組物質中,不能滿足如圖一步轉化關系的選項是( )
6.下列各組物質中,不能滿足如圖一步轉化關系的選項是( )編號 X Y Z ① Mg MgO MgCl2 ② H2SO4 SO2 SO3 ③ SiO2 H2SiO3 Na2SiO3 ④ Na NaOH NaHCO3 ⑤ Cu CuSO4 Cu(OH)2 ⑥ C CO CO2 ⑦ Cl2 HCl HClO ⑧ N2 NH3 NO A.①②⑥⑦ B.①③④⑦⑧ C.③④⑤ D.③④⑤⑥⑦ 組卷:15引用:2難度:0.7 -
7.某溶液中除H+、OH-外,還含有大量的Mg2+、Fe3+、Cl-,且這三種離子的物質的量之比為1:1:6.下列有關該溶液的判斷正確的是( )
A.向該溶液中加入稀NaOH溶液,立即產生白色沉淀 B.向該溶液中加入KI溶液后,原有的五種離子物質的量不變 C.若溶液中c(Cl-)=0.6 mol/L,則該溶液的pH為1 D.向該溶液中加入過量鐵粉,只能發生置換反應 組卷:36引用:14難度:0.7
二、填空題(52分)
-
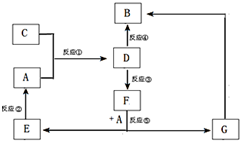 21.A、B、C、D、E、F、G七種物質間存在如圖所示的轉化關系,其中A、B、D、G含有同種元素.已知:(Ⅰ)A為金屬單質; B為紅褐色固體;E為密度最小的氣體;G為淺綠色溶液.
21.A、B、C、D、E、F、G七種物質間存在如圖所示的轉化關系,其中A、B、D、G含有同種元素.已知:(Ⅰ)A為金屬單質; B為紅褐色固體;E為密度最小的氣體;G為淺綠色溶液.
(Ⅱ)D為黃色溶液,能與硝酸銀溶液反應生成不溶于稀硝酸的白色沉淀.
(Ⅲ)D能將某種氧化物氧化為F,F是含有三種元素的化合物.
請回答下列問題:
(1)上述反應中屬于置換反應的是(填序號).
(2)G生成B有多種途徑.若在G的溶液中加入與G等物質的量的Na2O2,恰好使G轉化為F,寫出該反應的離子方程式:反應③(即D將某種氧化物氧化為F)的離子方程式
(3)實驗室制取C的化學方程式為對氣體C進行如下實驗.已知整個反應過程中,每消耗0.1mol KI,轉移的電子數約為3.612×1023個.請按照要求填空:
實驗步驟 實驗現象 用化學用語解釋 將少量氣體通入淀粉KI溶液 溶液最初變成 色(用離子方程式表示) 繼續通入氣體 溶液逐漸變成無色 (用化學方程式表示) 組卷:14引用:3難度:0.5 -
22.中學階段涉及的平衡有氣體可逆反應的平衡、酸堿電離平衡、水解平衡及沉淀-溶解平衡等等.
(1)現有容積為1L的恒溫恒容密閉容器,向其中加入2mol A氣體和2mol B氣體后發生如下反應:A(g)+B(g)═C(g)△H=-a kJ?mol-1,20s后,反應達到平衡狀態,生成1mol C氣體,放出熱量Q1kJ.回答下列問題.
①計算20s內B氣體的平均化學反應速率為,寫出該反應的平衡常數表達式.
②保持容器溫度和容積不變,若改為向其中加入1molC氣體,反應達到平衡時,吸收熱量Q2kJ,則Q1與Q2的相互關系正確的是(填字母).
(A)Q1+Q2=a (B) Q1+2Q2<2a (C)Q1+2Q2>2a (D)Q1+Q2<a
③在原平衡基礎上,保持容器溫度和容積不變,向容器中再通入bmolA氣體(b>0)時,v(正)v(逆)(填“>”、“<”或“=”),重新達平衡后,C氣體的平衡體積分數φ(C)=,則b=13.
(2)常溫下,將VmL、0.1000mol?L-1氫氧化鈉溶液逐滴加入到20.00mL、0.1000mol?L-1醋酸溶液中,充分反應.回答下列問題.(忽略溶液體積的變化)
①如果溶液pH=7,此時V的取值20.00(填“>”、“<”或“=”),而溶液中c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小關系為.
②如果V=40.00,則此時溶液中c(OH-)-c(H+)-c(CH3COOH)=mol?L-1.組卷:204引用:1難度:0.1


