2021-2022學年安徽省滁州市定遠縣民族中學高二(上)質(zhì)檢化學試卷
發(fā)布:2024/12/2 8:0:28
一、選擇題(每小題只有一個選項符合題意,每小題3分,共48分)
-
1.化學與生活、社會發(fā)展息息相關(guān),下列說法不正確的是( )
A.“霾塵積聚難見路人”,霧霾所形成的氣溶膠有丁達爾效應(yīng) B.“熬膽礬鐵釜,久之亦化為銅”,該過程發(fā)生了置換反應(yīng) C.“青蒿一握,以水二升漬,絞取汁”,說明屠呦呦對青蒿素的提取屬于化學變化 D.“春蠶到死絲方盡,蠟炬成灰淚始干”詩句中涉及氧化還原反應(yīng) 組卷:148引用:25難度:0.7 -
2.下列關(guān)于純凈物、混合物、電解質(zhì)、非電解質(zhì)的正確組合為( )
純凈物 混合物 電解質(zhì) 非電解質(zhì) A 鹽酸 冰水混合物 硫酸 干冰 B 蒸餾水 蔗糖溶液 氧化鋁 二氧化硫 C 膽礬 鹽酸 鐵 碳酸鈣 D 碘酒 食鹽水 氯化銅 碳酸鈉 A.A B.B C.C D.D 組卷:51引用:5難度:0.7 -
3.設(shè)NA表示阿伏加德羅常數(shù)的值,下列判斷正確的是( )
A.24gMg變?yōu)镸g2+時失去的電子數(shù)為2NA B.46gNO2和N2O4混合氣體中含有原子總數(shù)為2.5NA C.23gNa與足量O2反應(yīng),生成Na2O和Na2O2的混合物,鈉失去1.5NA個電子 D.反應(yīng)KClO3+6HCl═KCl+3Cl2↑+3H2O中,生成3mol氯氣時轉(zhuǎn)移6NA個電子 組卷:18引用:1難度:0.8 -
4.某無色溶液既可能是強酸性又可能是強堿性,在該溶液中一定能大量共存的離子是( )
A.H+ Na+ MnO-4SO2-4B.Na+ Al3+ Cl-CO2-3C.K+ Na+ Cl- SO2-4D.K+ Cl- Ba2+ HCO-3組卷:16引用:3難度:0.9 -
5.做實驗時不小心使皮膚上沾了一些高錳酸鉀,形成的黑斑很久才能消除,如果用草酸(乙二酸,化學式為H2C2O4)的稀溶液洗滌,黑斑可以迅速褪去,其離子方程式為
+H2C2O4+H+→CO2↑+Mn2++□(未配平)。下列敘述不正確的是( )MnO-4A.發(fā)生氧化反應(yīng)的是H2C2O4 B.每消耗6個H+,轉(zhuǎn)移5個電子 C.還原性:Mn2+<H2C2O4 D.離子方程式右側(cè)方框內(nèi)的產(chǎn)物是H2O 組卷:32引用:3難度:0.7 -
6.下列表達方式中錯誤的是( )
A.次氯酸電子式: 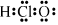
B.S2-的結(jié)構(gòu)示意圖: 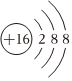
C.O-18的原子符號: O188D.CO2分子的結(jié)構(gòu)式:O=C=O 組卷:68引用:14難度:0.5
二、填空題(本題有4小題,每空2分,共52分)
-
19.實驗室制備無水乙醇常用蒸餾法,實驗步驟如下:
Ⅰ.回流:在100 mL圓底燒瓶中加入10g小顆粒狀的生石灰和幾顆氫氧化鈉,慢慢注入50 mL工業(yè)乙醇,回流1h。
Ⅱ.蒸餾:回流畢,待燒瓶冷卻后在燒瓶中加入幾粒沸石,改為蒸餾裝置,收集78℃時的餾分,即為無水乙醇。回流和蒸餾裝置如圖(用△表示酒精燈)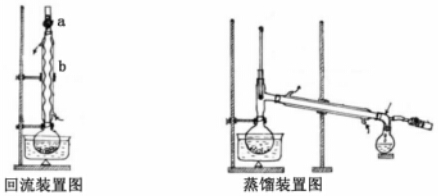
回答下面問題:
(1)裝置b的名稱是。
(2)簡述向燒瓶中加入生石灰的方法。
(3)加入NaOH固體是為了除去工業(yè)乙醇中少量的醛,發(fā)生的關(guān)鍵反應(yīng)為
CH3CHO+CH3CHONaOH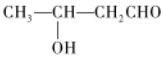
該反應(yīng)的反應(yīng)類型為,回流lh的目的是。
(4)蒸餾時,先,后(①點燃酒精燈②接通冷凝水,填代號),待溫度計指示為78℃左右時,尾接管中出現(xiàn)液滴,棄去開始流出的液體,原因是。
(5)有同學建議改蒸餾為過濾,請回答過濾法不妥的原因。組卷:11引用:4難度:0.5 -
20.已知E1=134kJ/mol、E2=368kJ/mol,請參考題中圖表,按要求填空:
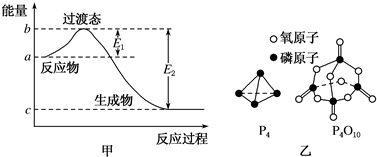
(1)圖甲是1mol NO2(g)和1mol CO(g)反應(yīng)生成CO2(g)和NO(g)過程中的能量變化示意圖,若在反應(yīng)體系中加入催化劑,反應(yīng)速率加快,E1的變化是(填“增大”“減小”或“不變”,下同),△H的變化是。NO2和CO反應(yīng)的熱化學方程式為。
(2)捕碳技術(shù)(主要指捕獲CO2)在降低溫室氣體排放中具有重要的作用。目前NH3和(NH4)2CO3已經(jīng)被用作工業(yè)捕碳劑,它們與CO2可發(fā)生如下可逆反應(yīng):
反應(yīng)Ⅰ:2NH3(l)+H2O(l)+CO2(g)═(NH4)2CO3(aq)△H1
反應(yīng)Ⅱ:NH3(l)+H2O(l)+CO2(g)═NH4HCO3(aq)△H2
反應(yīng)Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)═2NH4HCO3(aq)△H3
則△H3與△H1、△H2之間的關(guān)系是△H3=。
(3)下表所示是部分化學鍵的鍵能參數(shù):
已知P4(g)+5O2(g)═P4O10(g)△H=-d kJ?mol-1,P4及P4O10的結(jié)構(gòu)如圖乙所示。表中x=化學鍵 P-P P-O O═O P═O 鍵能/kJ?mol-1 a b c x kJ?mol-1.(用含a、b、c、d的代數(shù)式表示)組卷:92引用:5難度:0.6


