滬教版九年級下冊《7.2 常見的酸和堿》2019年同步練習卷(江蘇省鎮(zhèn)江市丹徒區(qū)石馬中學)(B)
發(fā)布:2024/4/20 14:35:0
一、選擇題
-
1.下列物質放入滴加了酚酞試液的水中,能使其變紅的是( )
①氫氧化鈣②氫氧化鎂③氧化銅④氯化鈉溶液 ⑤燒堿溶液⑥氨水⑦鹽酸⑧二氧化硫A.①②③⑤⑥ B.④⑦⑧ C.①②⑤⑥ D.①⑤⑥ 組卷:71引用:1難度:0.6 -
2.下列物質敞口放置于空氣中,溶液的質量增加且會變質的是( )
A.濃H2SO4 B.NaCl溶液 C.NaOH溶液 D.濃HCl 組卷:22引用:1難度:0.5 -
3.下列潮濕的氣體不能用固體氫氧化鈉干燥的是( )
A.H2 B.CO2 C.CO D.O2 組卷:73引用:20難度:0.9 -
4.下列反應的化學方程式的書寫完全正確的是( )
A.CuO+CO═Cu+CO2 B.2NaOH+SO2═Na2SO4+H2O C.2Fe+6HCl═2FeCl3+3H2↑ D.CaCO3+2HNO3═Ca(NO3)2+H2O+CO2↑ 組卷:15引用:1難度:0.6
二、填空題
-
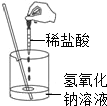 12.如右圖所示,田繪同學在進行酸堿中和反應的實驗時,向燒杯中的氫氧化鈉溶液滴加稀鹽酸一會兒后,發(fā)現(xiàn)忘記了滴加指示劑.為了確定鹽酸與氫氧化鈉是否恰好完全反應,田繪從燒杯中取少量反應后的溶液放于一支試管中,并向試管中滴加幾滴無色酚酞試液,振蕩后觀察到酚酞試液不變色.于是她得出“兩種物質已恰好完全中和”的結論.
12.如右圖所示,田繪同學在進行酸堿中和反應的實驗時,向燒杯中的氫氧化鈉溶液滴加稀鹽酸一會兒后,發(fā)現(xiàn)忘記了滴加指示劑.為了確定鹽酸與氫氧化鈉是否恰好完全反應,田繪從燒杯中取少量反應后的溶液放于一支試管中,并向試管中滴加幾滴無色酚酞試液,振蕩后觀察到酚酞試液不變色.于是她得出“兩種物質已恰好完全中和”的結論.
(1)你認為她得出的結論是否正確?,理由是:.
(2)寫出該中和反應的化學方程式.
(3)請你另設計一個實驗,探究上述燒杯中的溶液是否恰好完全中和,填寫下表實 驗 方 法 可能觀察到的現(xiàn)象 結 論 組卷:143引用:25難度:0.5 -
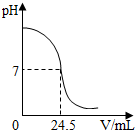 13.利用中和反應可以測定酸或堿溶液中溶質的質量分數(shù)。例如,在一定量的待測酸(或堿)溶液中逐滴加入已知質量分數(shù)的堿(或酸)溶液(標準溶液),直到酸、堿正好完全反應,根據(jù)消耗標準堿(或酸)溶液的多少即可求算出待測酸(或堿)溶液的質量分數(shù)。圖為某次測定過程中,溶液的pH隨所滴加的某標準溶液體積的變化而變化的關系圖。
13.利用中和反應可以測定酸或堿溶液中溶質的質量分數(shù)。例如,在一定量的待測酸(或堿)溶液中逐滴加入已知質量分數(shù)的堿(或酸)溶液(標準溶液),直到酸、堿正好完全反應,根據(jù)消耗標準堿(或酸)溶液的多少即可求算出待測酸(或堿)溶液的質量分數(shù)。圖為某次測定過程中,溶液的pH隨所滴加的某標準溶液體積的變化而變化的關系圖。
(1)根據(jù)如圖曲線可以判斷實驗中是向(填“酸”或“堿”,下同)溶液(待測液)中滴加溶液(標準液)。
(2)在這次測定中,為了指示中和反應剛好完全,用酚酞作指示劑,即在待測溶液中先滴入幾滴酚酞試液,若看到,則證明中和反應正好完成。
(3)如果實驗中使用的酸是硫酸,堿是氫氧化鈉,且待測液和標準液的密度均以1.0g/mL計。若測定中取用待測液25mL,標準液溶質的質量分數(shù)為4.5%,根據(jù)圖中數(shù)據(jù),計算待測液溶質的質量分數(shù)。組卷:70引用:12難度:0.1


