2022-2023學年北京市八一學校高二(上)期中化學試卷
發布:2024/10/2 9:0:1
一、單選題(本題包括18小題,1-12題每小題2分,13-18題每小題2分,共42分)
-
1.下列鐵制品防護的裝置或方法中,不正確的是( )
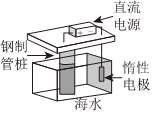
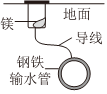

A B C D A.A B.B C.C D.D 組卷:6引用:1難度:0.5 -
2.25℃和1.01×105Pa時,2N2O5(g)═4NO2(g)+O2(g)ΔH=+56.76kJ/mol,該反應能自發進行的原因是( )
A.是吸熱反應 B.是放熱反應 C.是熵減少的反應 D.熵增大效應大于焓效應 組卷:77引用:7難度:0.8 -
3.硫酸工業中的核心反應:2SO2(g)+O2(g)?2SO3(g)ΔH=-197kJ/mol,如果要提高SO2的平衡轉化率,下列措施不可行的是( )
A.增大O2的濃度 B.增大壓強 C.升高溫度 D.及時將SO3從反應體系中移走 組卷:0引用:1難度:0.5 -
4.在恒容密閉容器中反應:2NO(g)+2CO(g)?N2(g)+2CO2(g) ΔH=-373.4kJ?mol-1達到平衡狀態,以下說法不正確的是( )
A.及時分離出CO2,使Q減小,Q<K,因此平衡正向移動 B.及時補充CO,使Q減小,Q<K,因此平衡正向移動 C.加入催化劑可增大反應速率,從而增大一段時間內的反應物轉化率 D.降低溫度,使Q減小,Q<K,因此平衡正向移動 組卷:2引用:1難度:0.7 -
5.在密閉容器中發生下列反應:aA(g)═cC(g)+dD(g),反應達到平衡后,將氣體體積壓縮到原來的一半,當再次達到平衡時,D的濃度為原平衡的1.8倍,下列敘述正確的是( )
A.平衡向正反應方向移動 B.a<c+d C.D的體積分數增大 D.A的轉化率變大 組卷:65引用:15難度:0.9 -
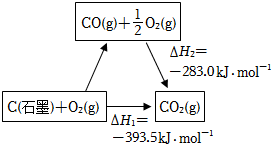 6.依據圖示關系,下列說法不正確的是( )
6.依據圖示關系,下列說法不正確的是( )A.1molC(石墨)和1molCO分別在足量O2中燃燒,全部轉化為CO2,前者放熱多 B.石墨燃燒是放熱反應 C.C(石墨)+CO2(g)═2CO(g) ΔH=ΔH1-ΔH2 D.化學反應的ΔH,只與反應體系的始態和終態有關,與反應途徑無關 組卷:127引用:11難度:0.6 -
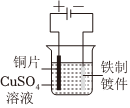
7.關于如圖裝置的說法正確的是( )
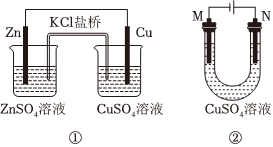 ?
?A.裝置①中鹽橋內的K+移向CuSO4溶液 B.裝置①將電能轉變為化學能 C.若裝置②用于電解硫酸銅溶液,M、N為惰性電極,電解一段時間后,加入Cu(OH)2能使原溶液恢復 D.若裝置②用于電解精煉銅,溶液中的Cu2+濃度保持不變 組卷:4引用:1難度:0.5
二、填空題(共58分)
-
22.氨在能源、化肥生產等領域有著非常重要的用途。
?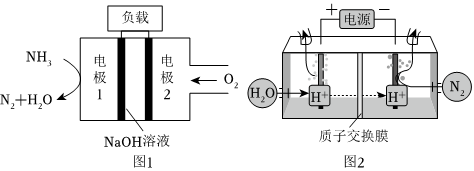
(1)25℃時,NH3和O2能反應生成NO和液態水,生成6mol水時放出1289kJ的熱量,其熱化學方程式是。
(2)與H2-O2燃料電池相比,氨易液化,運輸和儲存方便,安全性能更高。新型NH3-O2燃料電池原理如圖1所示:
①電極1為(填“正極”或“負極”),電極2的反應式為。
②氨氣也可以在純氧中燃燒,此時化學能轉化為熱能。
已知:2H2(g)+O2(g)═2H2O(g)ΔH1
N2(g)+3H2(g)?2NH3(g)ΔH2
4NH3(g)+3O2(g)═2N2(g)+6H2O(g)ΔH3
ΔH1、ΔH2、ΔH3之間的關系式為:ΔH3=。
③與熱能相比,電能具有更高的利用價值,燃料電池可將化學能直接轉化為電能的原因是原電池可將氧化反應與還原反應進行,使得電子發生定向移動,形成電流。
(3)請結合下列數據分析,工業上選用氮氣與氫氣反應固氮,而沒有選用氮氣和氧氣反應固氮的原因是。
(4)常溫常壓下電解法合成氨的原理如圖2所示:序號 化學反應 K(298K)的數值 ① N2(g)+O2(g)?2NO(g) 5×10-31 ② N2(g)+3H2(g)?2NH3(g) 4.1×106
①陽極產生的氣體是。
②陰極生成氨的電極反應式為。
③經檢測在陰極表面發生了副反應,導致氨的產量降低。寫出該副反應的電極反應式。組卷:2引用:1難度:0.4 -
23.為探究化學平衡移動原理與氧化還原反應規律的聯系,某同學對Na2SO3溶液和鉻(Ⅵ)鹽溶液的反應規律進行研究,并進行如下實驗:
已知:①Cr2(橙色)+H2O?2O2-7(黃色)+2H+CrO2-4
②鉻(Ⅵ)鹽即六價的鉻鹽,被還原生成Cr3+(綠色)
(1)進行實驗ⅰ和ⅱ:
用離子方程式解釋ⅰ中現象:序號 操作 現象 i 向2mLpH=2的0.05mol?L-1K2Cr2O7橙色溶液中滴加飽和Na2SO3溶液(pH約為9)3滴 溶液變綠色(含Cr3+) ii 向2mLpH=8的0.1mol?L-1K2CrO4黃色溶液中滴加飽和Na2SO3溶液3滴 溶液沒有明顯變化 。
(2)繼續進行實驗ⅲ:
為了說明產生上述現象的原因,補充實驗:序號 操作 現象 ⅲ 向2mL飽和Na2SO3溶液中滴加pH=2的0.05mol?L-1K2Cr2O7橙色溶液3滴 溶液變黃色
向2mL蒸餾水中滴加pH=2的0.05mol?L-1K2Cr2O7橙色溶液3滴,溶液變成淺橙色。
①補充實驗的目的是。
②用化學平衡移動原理解釋ⅲ中現象:。
③根據實驗ⅰ~ⅲ,可推測:Na2SO3溶液和鉻(Ⅵ)鹽溶液的反應與溶液酸堿性有關。
a.堿性條件下,Na2SO3溶液和鉻(Ⅵ)鹽溶液不發生氧化還原反應;
b.。
④向實驗ⅲ所得黃色溶液中繼續滴加硫酸,產生的現象證實了上述推測。該現象是。
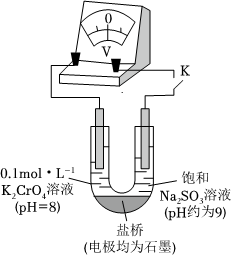
(3)為探究溶液酸性增強對Na2SO3溶液還原性或鉻(Ⅵ)鹽溶液氧化性的影響,該同學利用如圖裝置繼續實驗(已知電壓大小反映了物質氧化還原性強弱的差異;物質氧化性與還原性強弱差異越大,電壓越大)。
a.K閉合時,電壓為x。
b.向U型管左側溶液中滴加硫酸至pH=2后,電壓增大了y。
c.繼續向U型管右側溶液中滴加硫酸后,無氣體逸出,電壓幾乎不變。
①上述實驗說明:。
②有同學認為該實驗不夠嚴謹,理由是:也會使電壓增大于是補做了一個實驗:U型管左管中盛放pH=8的0.1mol/LK2SO4溶液,右管盛放飽和Na2SO3溶液,閉合K記錄電壓;先向左管溶液中滴加硫酸至pH=2后,記錄電壓,測得電壓增大了z,z<y證明實驗結論不受影響。組卷:14引用:2難度:0.6


