2021-2022學年河南省南陽一中高三(上)第一次月考化學試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題(每小題只有一個選項符合題意,3*16=48分)
-
1.關(guān)于強弱電解質(zhì)及非電解質(zhì)的組合完全正確的是( )
A B C D 強電解質(zhì) NaCl H2SO4 CaCO3 HNO3 弱電解質(zhì) HF BaSO4 HClO HI 非電解質(zhì) Cl2 蔗糖 C2H5OH SO2 A.A B.B C.C D.D 組卷:59引用:8難度:0.9 -
2.下列說法與鹽的水解有關(guān)的是( )
①明礬可以作凈水劑
②實驗室配制FeCl2溶液時,往往在FeCl2溶液中加入少量的鐵粉
③用NaHCO3和Al2(SO4)3兩種溶液可作泡沫滅火劑
④《禮記?內(nèi)則》記載:“冠帶垢,和灰清漱;衣裳垢,和灰清浣。”
⑤在HCl的氣流中,蒸發(fā)MgCl2溶液制備MgCl2固體
⑥在飽和氯化鈉溶液中,通入HCl氣體,產(chǎn)生白色沉淀A.①②③④ B.①③④⑤ C.①③⑤⑥ D.②④⑤⑥ 組卷:102引用:3難度:0.7 -
3.在相同溫度時,100mL 0.01mol/L的氨水溶液與10mL 0.1mol/L的氨水溶液相比較,下列數(shù)值中,前者大于后者的是( )
A.中和時所需HCl的量 B.NH3?H2O的電離常數(shù) C.OH-的物質(zhì)的量 D.NH4+的物質(zhì)的量濃度 組卷:13引用:2難度:0.5 -
4.下列事實一定能說明HA是弱酸的是( )
A.常溫下,NaA溶液的pH大于7 B.HA能與Na2CO3溶液反應,產(chǎn)生CO2氣體 C.1mol?L-1HA的水溶液能使紫色石蕊溶液變紅 D.用HA溶液做導電性實驗,燈光很暗 組卷:34引用:3難度:0.7 -
5.部分弱酸的電離平衡常數(shù)如表所示:
下列選項錯誤的是( )弱酸 HCOOH HCN H2CO3 H2SO3 電離平衡(25℃) Ka=1.77×10-4 Ka=4.9×10-10 Ka1=4.3×10-7
Ka2=5.6×10-11Ka1=1.54×10-2
Ka2=1.02×10-7A.等體積等濃度的HCOONa和NaCN溶液中所含陰離子總數(shù)前者大于后者 B.少量SO2通入Na2CO3溶液中:SO2+H2O+CO32-=SO32-+H2CO3 C.中和等體積等pH的HCOOH和HCN消耗NaOH的量前者小于后者 D.CN-+H2O+CO2=HCN+HCO3- 組卷:99引用:3難度:0.7 -
6.等物質(zhì)的量濃度、等體積的下列溶液中:①H2CO3;②Na2CO3;③NaHCO3;④NH4HCO3;⑤(NH4)2CO3,下列關(guān)系或者說法不正確的是( )
A.③④⑤既能與鹽酸反應,又能與NaOH溶液反應 B.將溶液蒸干灼燒只有②能得到對應的固體物質(zhì) C.c(HCO3-)的大小關(guān)系為④>③>②>⑤>① D.c(CO32-)的大小關(guān)系為②>⑤>③>④>① 組卷:81引用:1難度:0.7 -
7.常溫下,Kb(NH3?H2O)=1.76×10-5,Ka(CH3COOH)=1.75×10-5,Ka(HCN)=6.2×10-10,Ka(HF)=6.31×10-4,下列說法正確的是( )
A.用相同濃度的NaOH溶液分別滴定等體積pH均為3的HF和CH3COOH溶液中至終點,前者消耗NaOH溶液的體積較大 B.0.2mol?L-1CH3COONa與0.1mol?L-1鹽酸等體積混合后的溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) C.0.2 mol?L-1 HCN 與 0.1 mol?L-1 NaOH 等體積混合后的溶液中:c(CN-)+c(OH-)<c(HCN)+c(H+) D.濃度均為 0.1 mol?L-1 的 NaCN 和 NH4Cl 溶液中水的電離程度:前者小于后者 組卷:39引用:2難度:0.5
三、選做題
-
20.銅是人類最早使用的金屬之一,銅的使用對早期人類文明的進步影響深遠。按要求回答下列問題。
(1)基態(tài)Cu與Cu2+中未成對電子數(shù)之比為。
(2)白銅是銅鎳合金,呈銀白色,有金屬光澤,白銅中存在的化學鍵是;元素銅與鎳的第二電離能分別為I(Cu)=1958kJ?mol-1、I(Ni)=1753kJ?mol-1,I(Cu)>I(Ni)的原因是銅的核電荷數(shù)較大,且。
(3)某含銅配合物的結(jié)構(gòu)簡式如圖1所示,其中Cu2+的配位數(shù)是,C原子的雜化類型為;C、N、O三種元素的簡單氫化物中能形成氫鍵的是。(填化學式)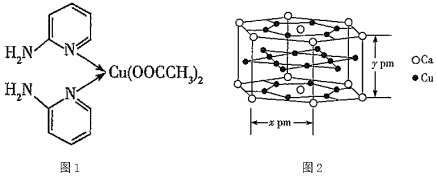
(4)兩種或兩種以上的金屬元素在一定條件下以它們原子數(shù)的整數(shù)比相結(jié)合而成的化合物,通常叫金屬互化物。
①金屬互化物ZnCu中所有金屬原子均按面心立方最密堆積,若所有Cu原子均位于晶胞的面心,則Zn原子位于晶胞的。
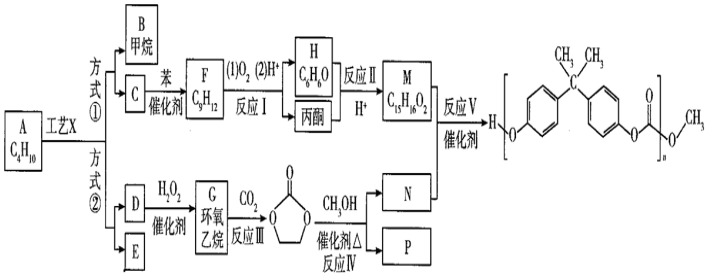
②一種Ca、Cu形成的金屬互化物的晶體結(jié)構(gòu)如圖2所示,設阿伏加德羅常數(shù)的值為NA,則該金屬互化物的密度是g?cm-3。(列出表達式即可)組卷:9引用:3難度:0.6 -
21.由于聚碳酸酯結(jié)構(gòu)的特殊性,芳香族聚碳酸酯已成為五大工程塑料中增長速度最快的通用工程塑料。某芳香族聚碳酸酯的合成路線如圖。
已知:①RCOOR1+R2OHRCOOR2+R1OH催化劑
②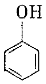 +
+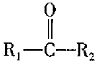 H+
H+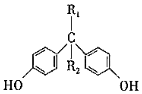 +H2O
+H2O
(1)工藝X的名稱為,有機物E的名稱是。
(2)C到F的反應類型為;有機物P的結(jié)構(gòu)簡式是。
(3)反應V的化學方程式為。
(4)有機物W的相對分子質(zhì)量是D的三倍,且二者的最簡式相同,滿足下列條件的W的同分異構(gòu)體的結(jié)構(gòu)簡式是。
①分子中含有甲基
②核磁共振氫譜顯示有2組峰
(5)已知:①2-COOH脫水劑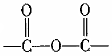 +H2O;
+H2O;
②內(nèi)酯型酚酞(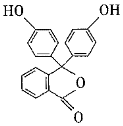 )在pH<0時可轉(zhuǎn)變?yōu)?img alt src="http://img.jyeoo.net/quiz/images/202102/59/86b5e583.png" style="vertical-align:middle" />。寫出以鄰二甲苯和苯酚為原料合成
)在pH<0時可轉(zhuǎn)變?yōu)?img alt src="http://img.jyeoo.net/quiz/images/202102/59/86b5e583.png" style="vertical-align:middle" />。寫出以鄰二甲苯和苯酚為原料合成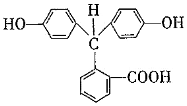 的合成路線:。(無機試劑任選)組卷:20引用:2難度:0.4
的合成路線:。(無機試劑任選)組卷:20引用:2難度:0.4


