2021-2022學(xué)年重慶八中高二(上)期中化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題(共14題,每小題3分,共42分)
-
1.下列能層中,不包含d能級(jí)的是( )
A.2 B.4 C.5 D.6 組卷:53引用:2難度:0.8 -
2.化學(xué)與社會(huì)、生產(chǎn)、生活密切相關(guān),下列說(shuō)法錯(cuò)誤的是( )
A.可先用純堿溶液處理鍋爐水垢中的CaSO4 B.工業(yè)上常用Na2S做沉淀劑除去廢水中Fe3+ C.在環(huán)保領(lǐng)域,堿性廢水可利用煙道氣中和 D.實(shí)驗(yàn)中常將FeCl3晶體溶于較濃鹽酸中配制FeCl3溶液 組卷:5引用:2難度:0.7 -
3.下列關(guān)于原子結(jié)構(gòu)的說(shuō)法不正確的是( )
A.原子光譜上的特征譜線可用于元素鑒定 B.同一原子中,2p、3p、4p電子的能量依次增強(qiáng) C.電子排布式為1s22s22p5的基態(tài)原子對(duì)應(yīng)元素位于周期表第五周期 D.日常生活中的焰火、LED燈都與原子核外電子躍遷釋放能量有關(guān) 組卷:49引用:2難度:0.7 -
4.下列所給溶液在空氣中蒸干灼燒后可得溶質(zhì)本身的是( )
A.AlCl3 B.FeSO4 C.Na2CO3 D.NH4HCO3 組卷:55引用:1難度:0.7 -
5.常溫下,水的電離達(dá)到平衡:H2O?H++OH-,下列敘述正確的是( )
A.升高溫度,Kw增大,溶液仍呈中性,pH不變 B.向水中加入少量硫酸,c(H+)增大,Kw不變 C.加入NaOH固體,抑制水的電離,c(OH-)降低 D.加入NH4Cl固體,平衡正向移動(dòng),c(OH-)增大 組卷:72引用:1難度:0.8 -
6.下列相關(guān)化學(xué)用語(yǔ)和說(shuō)法使用不當(dāng)?shù)氖牵ā 。?/h2>
A.向偏鋁酸鈉溶液中加入適量小蘇打發(fā)生雙水解:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32- B.向氯化銀懸濁液中加入適量KI溶液,證明AgI比AgCl更難溶:AgCl(s)+I-(aq)?AgI(s)+Cl-(aq) C.用TiCl4制備TiO2的反應(yīng)原理為鹽類水解:TiCl4+(x+2)H2O=TiO2?xH2O↓+4HCl D.亞硫酸氫鈉溶液因電離強(qiáng)于水解而顯酸性:HSO3-?H++SO32- 組卷:64引用:1難度:0.5
二、非選擇題(共5題,共58分)
-
18.電解質(zhì)的溶液中存在著眾多的化學(xué)平衡,請(qǐng)按要求填空。
(1)用離子方程式表示Al2(SO4)3溶液顯酸性的原因。
(2)用離子方程式表示泡沫滅火器的工作原理。
(3)常溫下,下列說(shuō)法正確的是(填字母序號(hào))。
a.pH相等的氨水和Ba(OH)2溶液,同時(shí)稀釋10倍后,Ba(OH)2溶液中c(OH-)大
b.0.1mol?L-1的鹽酸和醋酸溶液,同時(shí)稀釋10倍后,鹽酸溶液的pH更小
c.pH=2的CH3COOH溶液和pH=2的H2SO4溶液,c(CH3COO-)=2c(SO42-)
(4)25℃時(shí),pH=6的CH3COOH與CH3COONa的混合溶液中,c(CH3COO-)-c(Na+)=(填準(zhǔn)確數(shù)值)。
(5)25℃時(shí),將10mL0.1mol?L-1的鹽酸與20mL0.1mol?L-1氨水混合后溶液顯堿性,將此時(shí)溶液中所含粒子(包括離子和除水外的分子)的濃度由大到小排序。組卷:59引用:1難度:0.6 -
19.堿式氯化銅是重要的無(wú)機(jī)殺菌劑,是一種綠色或墨綠色結(jié)晶性粉末,難溶于水,溶于稀酸和氨水,在空氣中十分穩(wěn)定。
Ⅰ.模擬制備堿式氯化銅。向CuCl2溶液中通入NH3和HCl,調(diào)節(jié)pH至5.0~5.5,控制反應(yīng)溫度于70~80℃,實(shí)驗(yàn)裝置如圖所示(部分夾持裝置已省略)。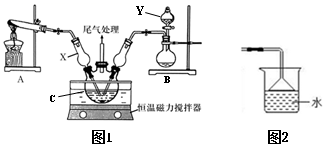
(1)儀器Y的名稱是;儀器X的主要作用有導(dǎo)氣、。
(2)下列說(shuō)法錯(cuò)誤的是。
A.可用如圖2裝置吸收尾氣,防止污染空氣
B.可用pH計(jì)不斷測(cè)定裝置C中溶液的pH,以達(dá)到實(shí)驗(yàn)要求
C.若體系NH3過(guò)多會(huì)導(dǎo)致堿式氯化銅的產(chǎn)量偏高
Ⅱ.無(wú)水堿式氯化銅含量的測(cè)定
(3)采用沉淀滴定法測(cè)定產(chǎn)品無(wú)水堿式氯化銅中的氯含量:稱取10g產(chǎn)品加硝酸溶解,得到200mL待測(cè)液。取20.00 mL待測(cè)液,向其中先加入30.00mL 0.1000mol?L-1的AgNO3溶液,再用0.1000 mol?L-1 NH4SCN的標(biāo)準(zhǔn)溶液滴定過(guò)量的AgNO3,發(fā)生反應(yīng):Ag++SCN-═AgSCN↓(已知:AgSCN是一種難溶于水的白色固體)。
①滴定時(shí),應(yīng)選用下列哪種物質(zhì)作為指示劑(填標(biāo)號(hào)),到達(dá)滴定終點(diǎn)的現(xiàn)象為。
a.FeSO4
b.Fe(NO3)3
c.FeCl3
②重復(fù)實(shí)驗(yàn)操作三次,消耗NH4SCN溶液的體積平均為12.50mL。則稱取的樣品中n(Cl-)為mol。組卷:9引用:1難度:0.5


