2015-2016學年四川省遂寧市射洪中學高二(下)開學化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本小題包括25個小題,每題2分,共50分,每題只有一個選項符合題意.)
-
1.食品干燥劑應無毒、無味、無腐蝕性及對環境友好.下列說法錯誤的是( )
A.生石灰氧化鈣可用作食品的防氧化劑 B.P2O5不可用作食品干燥劑 C.無水硅膠可用作食品干燥劑 D.加工后具有吸水性的植物纖維可用作食品干燥劑 組卷:38引用:1難度:0.9 -
2.下列化學反應中屬于吸熱反應的是( )
A.干冰的升華 B.鋁熱反應 C.八水合氫氧化鋇與氯化銨固體粉末混合 D.銅與濃硝酸反應 組卷:36引用:1難度:0.9 -
3.下列表示對應化學反應的離子方程式正確的是( )
A.向稀醋酸中滴加Na2SO3溶液: +2H+═SO2↑+H2OSO2-3B.向Na2SiO3溶液中通入過量SO2: +SO2+H2O═H2SiO3↓+SiO2-3SO2-3C.向Al2(SO4)3溶液中加入過量的NH3?H2O:Al3++4 NH3?H2O═[Al(OH)4]-+4 NH+4D.向CuSO4溶液中加入Na2O2:2 Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑ 組卷:13引用:12難度:0.7 -
4.W、X、Y、Z均為的短周期主族元素,原子序數依次增加,且原子核外L電子層的電子數分別為0、5、8、8,它們的最外層電子數之和為18.下列說法正確的是( )
A.單質的沸點:W>X B.陰離子的還原性:W>Z C.氧化物的水化物的酸性:Y<Z D.X與Y不能存在于同一離子化合物中 組卷:1489引用:63難度:0.9 -
5.1g碳與適量水蒸氣反應生成CO和H2,需吸收10.94KJ熱量,此反應的熱化學方程式為( )
A.C+H2O═CO+H2△H═+131.3KJ?mol-1 B.C(s)+H2O(g)═CO(g)+H2(g)△H=+10.94KJ?mol-1 C.C(s)+H2O(l)═CO(g)+H2(g)△H=+131.3KJ?mol-1 D.C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3KJ?mol- 組卷:161引用:22難度:0.9 -
6.在通風櫥中進行的下列實驗:
下列說法中不正確的是( )步驟 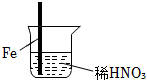
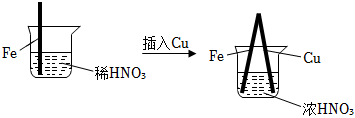
現象 Fe表面產生大量無色氣泡,液面上方變為紅棕色 Fe表面產生少量紅棕色氣泡后,迅速停止 Fe、Cu接觸后,其表面均產生紅棕色氣泡 A.Ⅰ中氣體由無色變紅棕色的化學方程式為:2NO+O2═2NO2 B.Ⅱ中的現象說明Fe表面形成致密的氧化層,阻止Fe進一步反應 C.對比Ⅰ、Ⅱ中現象,說明稀HNO3的氧化性強于濃HNO3 D.針對Ⅲ中現象,在Fe、Cu之間連接電流計,可判斷Fe是否被氧化 組卷:265引用:13難度:0.7 -
7.某化合物由兩種單質直接反應生成,將其加入Ba(HCO3)2溶液中同時有氣體和沉淀產生.下列化合物中符合上述條件的是( )
A.FeCl2 B.Na2O2 C.SO3 D.SiO2 組卷:36引用:2難度:0.7 -
8.將1000mL 0.1mol?L-1 BaCl2溶液與足量稀硫酸充分反應放出a kJ熱量;將1000mL 0.5mol?L-1 HCl溶液與足量CH3COONa溶液充分反應放出b kJ熱量(不考慮醋酸鈉水解);將500mL 1mol?L-1 H2SO4溶液與足量(CH3COO)2Ba(可溶性強電解質)溶液反應放出的熱量為( )
A.(5a-2b)kJ B.(2b-5a)kJ C.(5a+2b)kJ D.(10a+4b)kJ 組卷:74引用:18難度:0.9 -
9.在一定溫度下,10mL 0.40mol/L H2O2溶液發生催化分解,不同時刻測得生成O2的體積(已折算為標準狀況)如下表。
下列敘述不正確的是(溶液體積變化忽略不計)( )t/min 0 2 4 6 8 10 V(O2)/mL 0.0 9.9 17.2 22.4 26.5 29.9 A.0~6 min的平均反應速率:v(H2O2)≈3.3×10-2 mol/(L?min) B.6~10 min的平均反應速率:v(H2O2)<3.3×10-2 mol/(L?min) C.反應到6 min時,H2O2分解了50% D.反應到6 min時,c(H2O2)=0.30 mol/L 組卷:86引用:37難度:0.9
二、解答題(共4小題,滿分50分)
-
 28.科學家開發出一種“潔凈煤技術”,通過向地下煤層“氣化爐”中交替鼓入空氣和水蒸氣的方法,連續產出高熱值的煤炭氣,其主要成分是CO和H2.“氣化爐”中主要反應有:
28.科學家開發出一種“潔凈煤技術”,通過向地下煤層“氣化爐”中交替鼓入空氣和水蒸氣的方法,連續產出高熱值的煤炭氣,其主要成分是CO和H2.“氣化爐”中主要反應有:
C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3kJ?mol-1;
CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.2kJ?mol-1
(1)氣化爐中CO2與C反應轉化為CO,該反應的熱化學方程式是.
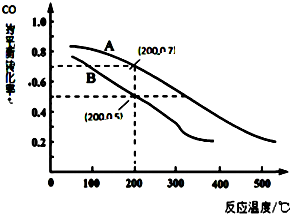
(2)用煤炭氣合成甲醇的反應為CO(g)+2H2(g)?CH3OH(g).在密閉容器中,將CO和H2按物質的量1:2混合反應CO的平衡轉化率與溫度、壓強的關系如圖所示.
①生成甲醇的反應為反應(填”放熱”或“吸熱”).
②圖中兩條曲線分別表示壓強為0.1MPa和5.0MPa下CO轉化率隨溫度的變化,其中代表壓強是5.0MPa的曲線是(填“A”或”B”).
③在不改變反應物用量的前提下,為提高CO轉化率可采取的措施有(答出一種即可).
④壓強為0.1MPa、溫度為200℃時,平衡混合氣中甲醇的物質的量分數是.
(3)某新型電池以熔融碳酸鹽作電解質,在650℃下工作,負極通入煤炭氣,正極通入空氣與CO2的混合氣.電池的正極反應式為,負極反應式為CO+CO32--2e-═2CO2和.組卷:9引用:1難度:0.5 -
 29.甲醇可以與水蒸氣反應生成氫氣,反應方程式如下:
29.甲醇可以與水蒸氣反應生成氫氣,反應方程式如下:
CH3OH(g)+H2O(g)?CO2(g)+3H2(g);△H>0
(1)一定條件下,向體積為2L的恒容器密閉容器中充入1molCH3OH(g)和3molH2O(g),20s后,測得混合氣體的壓強是反應前的1.2倍,則用甲醇表示該反應的速率為.
(2)判斷(1)中可逆反應達到平衡狀態的依據是(填序號).
①v正(CH3OH)=v正(CO2)
②混合氣體的密度不變
③混合氣體的平均相對分子質量不變
④CH3OH、H2O、CO2、H2的濃度都不再發生變化
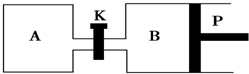
(3)如圖中P是可自由平行滑動的活塞,關閉K,在相同溫度時,向A容器中充入1molCH2OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g)和2.4molH2O(g),兩容器分別發生上述反應.
已知起始時容器A和B的體積均為aL.試回答:
①反應達到平衡時容器B的體積為1.5aL,容器B中CH3OH轉化率為A、B兩容器中H2O(g)的體積百分含量的大小關系為:B(填“>”、“<”、“=”)A.
②若打開K,一段時間后重新達到平衡,容器B的體積為L(連通管中氣體體積忽略不計,且不考慮溫度的影響).組卷:30引用:7難度:0.5


