2016-2017學年河南省新鄉一中高三(上)周考化學試卷(8.14)
發布:2024/4/20 14:35:0
一、選擇題.
-
1.釣魚島及其附屬島嶼是中國的固有領土,我國歷來十分重視海水資源的綜合利用,下列有關海水綜合利用的說法正確的是( )
A.利用潮汐發電是將化學能轉化為電能 B.海水蒸發制海鹽的過程中發生了化學變化 C.海水中含有溴元素,只需經過物理變化就可以得到溴單質 D.從海水中可以得到MgCl2,電解熔融MgCl2可制備Mg 組卷:24引用:5難度:0.9 -
2.下列描述正確的是( )
A.氨水上的標簽應標注 
B.乙烯的結構簡式:CH2CH2 C.O2-的結構示意圖: 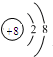
D.BeCl2的電子式: 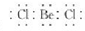 組卷:13引用:2難度:0.9
組卷:13引用:2難度:0.9 -
3.下列有關物質分類或歸納不正確的是( )
①電解質:明礬、冰醋酸、氯化銀、純堿
②化合物:BaCl2、Ca(OH)2、HNO3、HT
③混合物:鹽酸、漂白粉、水玻璃、水銀
④同素異形體:金剛石、石墨、C60.A.①② B.②③ C.③④ D.②④ 組卷:14引用:2難度:0.9 -
4.如圖為霧霾的主要成分示意圖.下列說法不正確的是( )
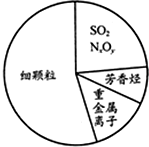
A.重金屬離子可導致蛋白質變性 B.苯是最簡單的芳香烴 C.SO2和NxOy都屬于酸性氧化物 D.汽車尾氣的大量排放是造成霧霾天氣的人為因素之一 組卷:225引用:16難度:0.9 -
5.常溫下,下列各組離子在指定溶液中一定能大量共存的是( )
A.pH=0的無色溶液:Al3+、Cu2+、 、Cl-SO2-4B.使酚酞試液變紅的溶液:Na+、Ca2+、 、HCO-3NO-3C.在c(H+)=l×l0-13mol?L-1的溶液中: 、Ba2+、Cl-、NH+4NO-3D.含有0.1mol?L-1Fe3+的溶液中:H+、Mg2+、 、SO2-4NO-3組卷:10引用:3難度:0.7 -
6.化學與生活、社會密切相關.下列說法不正確的是( )
A.可利用廢油脂制肥皂 B.合金中可能含有非金屬元素 C.水玻璃可用于制造木材防火劑 D.煤經氣化和液化的物理變化可變為清潔燃料 組卷:152引用:8難度:0.9 -
7.向溶液X中持續通入氣體Y,會產生“渾濁→澄清”現象的是( )
A.X:漂白粉溶液 Y:二氧化硫 B.X:硝酸鋇溶液 Y:二氧化硫 C.X:氯化鋁溶液 Y:氨氣 D.X:偏鋁酸鈉溶液 Y:二氧化氮 組卷:74引用:5難度:0.7 -
8.下列說法正確的是( )
A.用直接加熱氧化鋁的方法冶煉得到鋁 B.海水中含有鉀元素,只需經過物理變化可以得到鉀單質 C.從海水中可以得到NaCl,電解熔融NaCl可制備Cl2 D.高爐煉鐵的過程是通過置換反應得到鐵 組卷:31引用:4難度:0.7 -
9.24mL濃度為0.05mol?L-1的Na2SO3溶液,恰好與20mL濃度為0.02mol?L-1的K2Cr2O7溶液完全反應,已知Na2SO3能被K2Cr2O7氧化為Na2SO4,則元素Cr在還原產物中的化合價為( )
A.+2 B.+3 C.+4 D.+5 組卷:451引用:85難度:0.7 -
10.下列正確的是( )
A.SiO2 是酸性氧化物,能與NaOH溶液反應 B.Na2O、Na2O2組成元素相同,與 CO2反應產物也相同 C.做光導纖維的材料是單質硅晶體 D.將SO2通入溴水溶液中,溶液褪色,體現SO2的漂白性 組卷:15引用:3難度:0.7 -
11.氮化鋁(AlN)具有耐高溫、抗沖擊、導熱性好等優良性質,被廣泛應用于電子工業、陶瓷工業等領域.在一定條件下,氮化鋁可通過如下反應合成:Al2O3+N2+3C
2AlN+3CO.下列敘述正確的是( )高溫A.在氮化鋁的合成反應中,N2是還原劑,Al2O3是氧化劑 B.上述反應中每生成2 mol AlN,N2得到3 mol電子 C.氮化鋁中氮元素的化合價為-3 D.氮化鋁晶體屬于分子晶體 組卷:39引用:14難度:0.9
二、填空題.(每空2分,共20分)
-
32.已知物質A~I之間的轉化關系符合下圖所示.其中A、C、F、G、I為常見固體且焰色反應均為黃色;A為海水中主要溶質,B為常溫下常見液體;E為黃綠色氣體,H是無色無味且能使澄清石灰水變渾濁的氣體.
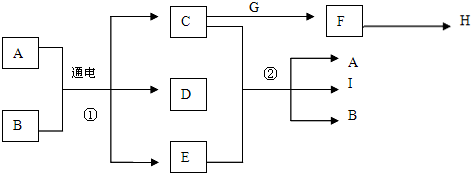
試回答下列問題:
(1)寫出下列物質的化學式:DH
(2)反應①的化學方程式為:.
(3)反應②的化學方程式為:.組卷:11引用:3難度:0.5
三、解答題(共1小題,滿分20分)
-
33.A、B、C、D、E均是短周期元素,其原子序數依次增大,A和B同周期,A和D同主族,A原子最外層電子數是內層電子數的二倍,B元素族序數是周期數的三倍,B的陰離子與C的陽離子電子層結構相同,C的單質與B的單質在不同條件下反應,可生成C2B或C2B2,E是所在周期中原子半徑最小的元素.
請回答:
(1)D在元素周期表中的位置是.
(2)C2B的電子式是;AB2的結構式是.
(3)B、C、E的離子半徑由大到小的順序為(用化學式回答,下同);A、D、E元素最高價氧化物對應水化物的酸性由強到弱為.
(4)B的氣態氫化物與H2S相比沸點高的是(用化學式回答);原因是.
(5)水中錳含量超標,容易使潔具和衣物染色,使水產生異味,EB2可以用來除去水中超標的Mn2+,生成黑色沉淀MnO2,當消耗13.50g EB2時,共轉移了1mol電子,則反應的離子方程式:.組卷:47引用:5難度:0.5


