2022-2023學(xué)年湖南省常德市臨澧一中高二(上)第三次月考化學(xué)試卷
發(fā)布:2024/9/30 0:0:1
一、單項(xiàng)選擇題(本大題共10題,每題只有一個正確答案,每小題3分,共30分)
-
1.下列有關(guān)熱化學(xué)方程式的敘述正確的是( )
A.已知C(石墨,s)?C(金剛石,s)ΔH>0,則金剛石比石墨穩(wěn)定 B.等質(zhì)量的硫蒸氣和硫固體分別完全燃燒,后者放出的熱量多 C.甲烷的燃燒熱為890.3kJ?mol-1,則甲烷燃燒的熱化學(xué)方程式可表示為CH4(g)+2O2(g)═CO2(g)+2H2O(g)ΔH═-890.3kJ?mol-1 D.已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)ΔH═-57.3kJ?mol-1,則含40.0gNaOH的稀溶液與稀醋酸完全中和,放出小于57.3kJ的熱量 組卷:38引用:4難度:0.9 -
2.下列說法正確的是( )
A.洗滌油污常用熱的Na2CO3溶液,這是利用了鹽類水解的原理 B.用加熱的方法就可以除去KCl溶液中的Fe3+ C.配制FeSO4溶液時,將FeSO4固體溶于稀鹽酸中,然后稀釋至所需濃度 D.將AlCl3溶液和Na2SO3溶液分別加熱蒸干、灼燒后,所得固體為Al2O3和Na2SO3 組卷:51引用:4難度:0.8 -
3.對下列現(xiàn)象或事實(shí)的解釋錯誤的是( )
選項(xiàng) 現(xiàn)象或事實(shí) 解釋 A 明礬可用于生活用水的凈化 Al(OH)3膠體具有殺菌消毒的作用 B 用鐵罐貯存濃硝酸 常溫下鐵在濃硝酸中鈍化 C 用氯化鐵溶液蝕刻覆銅線路板 Fe3+的氧化性比Cu2+的強(qiáng) D 漂白粉在空氣中久置變質(zhì) Ca(ClO)2與CO2、H2O反應(yīng),生成的HClO分解 A.A B.B C.C D.D 組卷:17引用:3難度:0.7 -
4.下列說法不正確的是( )(已知:lg2=0.3)
A.c(H+)= 的溶液一定是中性KwB.Ka大的酸溶液中c(H+)一定比Ka小的酸溶液中c(H+)大 C.將pH=2的鹽酸和pH=4的硫酸等體積混合(混合后體積變化不計),所得溶液pH=2.3 D.常溫下,某溶液中由水電離出c(H+)=10-11mol/L時,此溶液的pH=11或者3 組卷:33引用:2難度:0.6 -
5.實(shí)驗(yàn)室用標(biāo)準(zhǔn)KMnO4溶液滴定未知濃度的FeSO4溶液,下列說法或操作正確的是( )
A.盛FeSO4溶液的錐形瓶滴定前用FeSO4溶液潤洗2~3次 B.選堿式滴定管盛放標(biāo)準(zhǔn)KMnO4溶液,并用碘化鉀淀粉溶液作指示劑 C.錐形瓶內(nèi)溶液顏色變化由黃色變淺紫色,立即記下滴定管液面所在刻度 D.滴定后俯視讀數(shù)會導(dǎo)致滴定結(jié)果偏低 組卷:48引用:3難度:0.6 -
6.在一定的溫度和壓強(qiáng)下,將按一定比例混合的CO2和H2通過裝有催化劑的反應(yīng)器可得到甲烷。
已知:CO2(g)+4H2(g)═CH4(g)+2H2O(g)ΔH═-165kJ?mol-1
CO2(g)+H2(g)═CO(g)+H2O(g)ΔH═+41kJ?mol-1
催化劑的選擇是CO2甲烷化技術(shù)的核心。在兩種不同催化劑作用下反應(yīng)相同時間,測CO2轉(zhuǎn)化率和生成CH4選擇性[CH4選擇性═]隨溫度變化的影響如圖所示。下列有關(guān)說法正確的是( )用于生成CH4的CO2物質(zhì)的量發(fā)生反應(yīng)的CO2物質(zhì)的量×100%
A.在260℃~320℃之間,以Ni-CeO2為催化劑,升高溫度,相同時間內(nèi)CH4的產(chǎn)率不變 B.延長W點(diǎn)的反應(yīng)時間,一定能提高CO2的轉(zhuǎn)化率 C.CO(g)+3H2(g)═CH4(g)+H2O(g)ΔH═+206kJ?mol-1 D.高于320℃后,以Ni為催化劑,隨溫度的升高CO2轉(zhuǎn)化率上升的原因是催化劑活性增大,反應(yīng)速率加快 組卷:19引用:2難度:0.6
三、填空題(本大題共4題,每空2分,共54分)
-
17.2022年7月13日,化學(xué)所碳中和中心召開碳中和會議,白春禮做了“在碳中和愿景下的能源化學(xué)”的特邀報告,戰(zhàn)略性闡述了二氧化碳轉(zhuǎn)化利用如何支撐實(shí)現(xiàn)碳中和目標(biāo)。現(xiàn)為實(shí)現(xiàn)碳中和目標(biāo),利用CO、CO2加氫制甲醇的有關(guān)反應(yīng)如下:
Ⅰ.2H2(g)+CO(g)CH3OH(g)ΔH1<0催化劑
Ⅱ.H2(g)+CO2(g)CO(g)+H2O(g)ΔH2>0催化劑
Ⅲ.3H2(g)+CO2(g)CH3OH(g)+H2O(g)ΔH3催化劑
(1)反應(yīng)Ⅰ的ΔH1═(用含ΔH2、ΔH3的式子表示)。
(2)要使反應(yīng)Ⅰ的反應(yīng)速率加快,可采取的措施有(填序號)。
A.縮小反應(yīng)容器的容積
B.往密閉容器中不斷通入氮?dú)?br />C.升高溫度
D.保持恒壓狀態(tài)不斷通入氮?dú)?nbsp; E.使用合適的催化劑
(3)一定溫度下,往5L反應(yīng)釜中充入1molCO2、3molH2,發(fā)生反應(yīng)Ⅲ,反應(yīng)了5min后,氣體總的物質(zhì)的量減少了20%,則0~5min內(nèi),H2的平均反應(yīng)速率v═。
(4)在不同溫度、壓強(qiáng)和相同催化劑條件下,發(fā)生反應(yīng)Ⅲ,初始時CO2、H2分別為1.0mol、3.0mol,測得H2的平衡轉(zhuǎn)化率[a(H2)]隨溫度和壓強(qiáng)的變化如圖1所示。
①如圖可知壓強(qiáng)p1、p2、p3的大小關(guān)系為。
②250℃、p3條件下,反應(yīng)的化學(xué)平衡常數(shù)Kp═(用含p3的式子表示,Kp═,p為各物質(zhì)的分壓,分壓═總壓×物質(zhì)的量分?jǐn)?shù))。p(CH3OH)p(H2O)p3(H2)p(CO2)
(5)在密閉容器中充入CO2、H2,發(fā)生上述反應(yīng)Ⅱ和反應(yīng)Ⅲ,在不同催化劑Cat1、Cat2作用下,測得溫度與甲醇選擇性的關(guān)系如圖2所示。在其他條件相同時,若想主要發(fā)生反應(yīng)Ⅲ,催化效率較高的是(填“Cat1”或“Cat2”。)。在Cat2作用下,溫度高于500℃時,甲醇的產(chǎn)率降低的可能原因是。 組卷:30引用:2難度:0.5
組卷:30引用:2難度:0.5 -
18.高鐵酸鉀是常見的水處理劑,工業(yè)上制備高鐵酸鉀有多種方法。某興趣小組以鐵屑為原料模擬制備高鐵酸鉀的流程如圖:
【查閱資料】高鐵酸鉀呈紫紅色,在酸性或中性溶液中快速產(chǎn)生O2。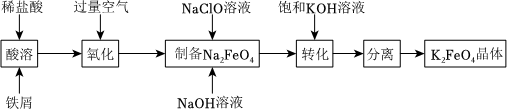
回答下列問題:
(1)“氧化”階段通入空氣作氧化劑,它比用氯氣具有的優(yōu)點(diǎn)是。
(2)為了檢驗(yàn)“氧化”過程中所得FeCl3溶液中是否還含有Fe2+,最佳的檢驗(yàn)試劑是(填標(biāo)號)。
a.K3[Fe(CN)6]溶液
b.NaOH溶液
c.淀粉KI試紙
(3)請寫出“制備”反應(yīng)的離子方程式。
(4)“轉(zhuǎn)化”過程使用過量飽和KOH溶液的原因是。
(5)“分離”過程獲得K2FeO4晶體的系列操作是蒸發(fā),結(jié)晶、過濾、洗滌、干燥,其中洗滌使用的最佳洗滌劑是(填標(biāo)號)。
a.冷水
b.冷的稀NaOH溶液
c.冷的濃KOH溶液
(6)電解法制備K2FeO4,操作簡單,易于實(shí)驗(yàn)室制備原理如圖所示,其中陽極的電極反應(yīng)式是。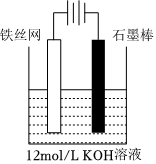
(7)探究K2FeO4的性質(zhì)。取電解后的紫紅色溶液,加入稀鹽酸,觀察到溶液由紫紅色逐漸變?yōu)辄S色,并收集到黃綠色氣體。甲同學(xué)認(rèn)為:氣體中一定含有Cl2;乙同學(xué)認(rèn)為:氣體中還可能含有別的氣體,請?jiān)O(shè)計實(shí)驗(yàn)證明乙同學(xué)的猜測。組卷:7引用:2難度:0.5


