2021-2022學年河南省焦作市普通高中高二(上)期中化學試卷
發(fā)布:2024/11/14 9:0:2
一、選擇題:本題共16小題,每小題3分,共48分.在每小題給出的四個選項中,只有一項是符合題目要求的.
-
1.化學與生產(chǎn)、生活密切相關(guān).下列說法錯誤的是( )
A.日前用量最大的合金是鋼 B.太陽能電池的半導體材料主要是Si C.“神舟十二號”飛船的操縱桿的主要成分為碳纖維,屬于有機高分子材料 D.科學家將CO2用于合成CH3OH,可實現(xiàn)二氧化碳的綠色利用 組卷:6引用:2難度:0.6 -
2.下列說法正確的是( )
A.化學反應中正反應一定比逆反應容易發(fā)生 B.吸熱反應一定要加熱才能發(fā)生 C.常溫下,為了加快鋁與稀硫酸的反應速率,可以用濃硫酸代替稀硫酸 D.反應NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)ΔH>0在常溫下能自發(fā)進行,是熵增起了主要作用 組卷:2引用:1難度:0.7 -
3.盧瑟福在核反應中用α粒子(即氦
He)轟擊原子42X,得到原子14ZY,同時發(fā)現(xiàn)了質(zhì)子,核反應為A+3Z+1X+14ZHe→42Y+A+3Z+1H,其中X、Y均為第二周期元素,其原子的最外層電子數(shù)之和為11.下列敘述錯誤的是( )11A. X與14ZN互為同位素137B.以上反應中共涉及四種核素 C.X、Y元素之間可以形成多種化合物 D.Y元素與H元素形成的化合物都只含極性鍵 組卷:8引用:1難度:0.7 -
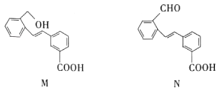 4.化合物M、N是兩種合成藥物的中間體.下列有關(guān)化合物M、N的說法正確的是( )
4.化合物M、N是兩種合成藥物的中間體.下列有關(guān)化合物M、N的說法正確的是( )A.M中有4種官能團 B.由M轉(zhuǎn)化為N的反應是氧化反應 C.M、N互為同分異構(gòu)體 D.1mol M最多可與8mol H2發(fā)生加成反應 組卷:8引用:1難度:0.5 -
5.利用工業(yè)廢氣中的CO、CO2合成有機物可以實現(xiàn)“碳中和”.
已知:①CO(g)+H2O(g)═HCOOH(g)ΔH1=-72.6kJ?mol-1
②2CO2(g)+6H2(g)═C2H4(g)+4H2O(g)ΔH2=-127.9kJ?mol-1
③CO2(g)+H2(g)═CO(g)+H2O(g)ΔH3=+41.2kJ?mol-1
下列有關(guān)說法錯誤的是( )A.由反應①可知HCOOH的氧化反應一定是吸熱反應 B.反應②中斷開化學鍵吸收的總能量小于形成化學鍵放出的總能量 C.CO2(g)+H2(g)═HCOOH(g)ΔH=-31.4kJ?mol-1 D.反應③的正反應活化能大于逆反應的活化能 組卷:11引用:1難度:0.5 -
6.工業(yè)上可利用CO2制備清潔液體燃料甲醇,有關(guān)反應為CO 2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.6 kJ?mol-1,下列說法正確的是( )
A.1molCO2(g)和3molH2(g)的總能量低于1molCH3OH(g)和1mol H2O(g)的總能量 B.可以把該反應設(shè)計成原電池,實現(xiàn)常溫下能量的轉(zhuǎn)化 C.使用催化劑可以提高反應物的平衡轉(zhuǎn)化率 D.使用催化劑可以提高反應速率和改變該反應的反應熱 組卷:2引用:1難度:0.5 -
7.下列依據(jù)熱化學方程式得出的結(jié)論正確的是( )
A.已知:異戊烷(g)=新戊烷(g)△H<0,則異戊烷比新戊烷穩(wěn)定 B.已知:S(s)+O2(g)═SO2(l)△H=-384kJ?mol-1,則硫的燃燒熱△H=-384kJ?mol-1 C.已知:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1,則稀鹽酸與Cu(OH)2反應生成1mol H2O(l)時,放出57.3kJ熱量 D.已知:4Na(s)+O2(g)═2Na2O(s)△H1;4Na(l)+O2(g)═2Na2O(s)△H2,則△H1>△H2 組卷:8引用:1難度:0.7
二、非選擇題:本題共6小題,共52分.
-
21.合成氨工藝是人工固氮的重要途徑,解決了數(shù)億人口生存問題。
(1)已知:①N2(g)+3H2(g)═2NH3(g)△H1=-92.4kJ?mol-1
②2H2(g)+3O2(g)═2H2O(l)△H2=-483.6kJ?mol-1
則4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=。
(2)合成氨的反應歷程可表示如下:
第一步:N2(g)→2N;H2(g)→2H(慢反應)
第二步:N+3H?NH3(g) (快反應)
①第一步反應的活化能大于第二步反應的活化能,理由是。
②下列關(guān)于合成氨反應條件的選擇是利用勒夏特列原理的是(填序號)。
A.選擇400~500℃
B.選擇10~30MPa
C.使用鐵觸媒催化劑
D.及時分離出氨氣
(3)在一定條件下,向某反應容器中充入1molN2、3molH2在不同溫度下反應,平衡體系中氨的物質(zhì)的量分數(shù)隨壓強變化的曲線如圖1所示: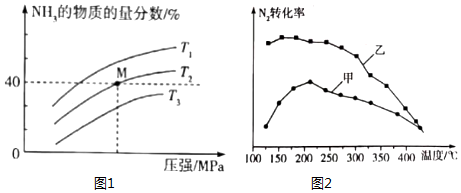
溫度T1、T2、T3由高到低的順序為,M點H2的平衡轉(zhuǎn)化率為%(保留一位小數(shù))。
(4)將N2和H2以一定的流速分別通過甲、乙兩種催化劑進行反應,相同時間內(nèi)測量逸出氣體中N2的含量,從而確定N2的轉(zhuǎn)化率,結(jié)果如圖2所示,則在合理的溫度下,(填“甲”或“乙”)催化劑的催化效果更好。組卷:6引用:1難度:0.6 -
22.合成SO3是生產(chǎn)硫酸的重要步驟,產(chǎn)生的尾氣SO2需要處理.回答下列問題。
(1)工業(yè)脫硫過程中會有副反應發(fā)生,已知:①CaSO4(s)+4CO(g)?CaS(s)+4CO2(g)ΔH1=-175.6kJ?mol-1;②CO的燃燒熱(ΔH2)為-110.5kJ?mol-1,則反應③CaS(s)+2O2(g)?CaSO4(s)ΔH=。
(2)煙氣中的SO2可采用活性炭脫除,其過程首先要經(jīng)物理吸附SO2→SO2*(*代表吸附態(tài))、O2→O2*、H2O→H2O*,然后是化學吸附(化學反應),如圖所示: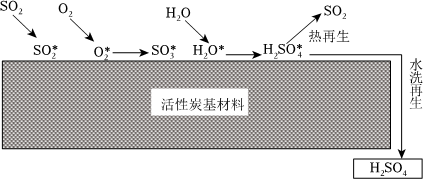
①寫出化學吸附過程中生成SO3的化學方程式:。
②一定溫度下,在密閉容器中發(fā)生反應:2SO3(g)+O2(g)?2SO3(g),下列有關(guān)說法正確的是(填序號)。
A.加入催化劑,有利于加快反應速率
B.容器中n(SO2)和n(SO3)的和不再改變時,可說明該反應達到化學平衡狀態(tài)
C.研發(fā)新的催化劑可以提高SO3的平衡產(chǎn)率
D.增加O2的物質(zhì)的量可提高SO2的平衡轉(zhuǎn)化率
(3)向某密閉容器中充入1mol SO2、1mol O2合成SO3時,SO2的平衡轉(zhuǎn)化率與反應溫度和壓強的關(guān)系如圖所示。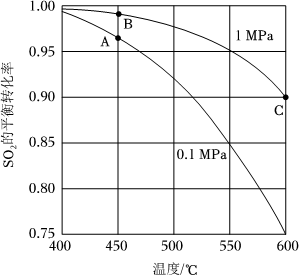
①該反應的ΔH0(填“>”或“<”)。
②圖中B點SO2的平衡轉(zhuǎn)化率高,但實際生產(chǎn)時選擇A點的反應條件,原因是。
③C點對應的Kp=MPa-1(結(jié)果保留一位小數(shù),Kp為用分壓表示的化學平衡常數(shù),分壓=總壓×物質(zhì)的量分數(shù))。組卷:8引用:2難度:0.7


