科粵版九年級下冊《7.4 結晶現象》2022年同步練習卷(1)
發布:2024/11/19 19:30:2
一、單選題
-
1.將70℃的硝酸鈉飽和溶液降溫到10℃,有晶體析出(晶體中不含水),下列各量沒有發生變化的是( )
A.硝酸鈉的溶解度 B.溶液中溶質的質量 C.溶液中溶劑的質量 D.溶液中溶質的質量分數 組卷:289引用:36難度:0.9 -
2.下列有關溶液的說法正確的是( )
A.飽和溶液一定是濃溶液 B.溶液是均一、穩定的混合物 C.溶液蒸發溶劑,一定會析出晶體 D.不飽和溶液一定是稀溶液 組卷:7引用:2難度:0.6 -
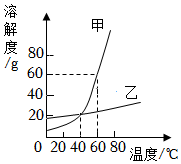 3.如圖為甲、乙兩種固體物質的溶解度曲線,下列說法正確的是( )
3.如圖為甲、乙兩種固體物質的溶解度曲線,下列說法正確的是( )A.20℃時,甲物質的溶解度比乙物質的溶解度小 B.甲物質中混有少量乙物質,采用蒸發結晶的方法提純甲物質 C.40℃時,甲、乙兩種物質的飽和溶液中溶質質量分數不相等 D.60℃時,將80g甲物質放入100g水中,所得溶液中溶質質量與溶劑質量之比是4:5 組卷:7引用:1難度:0.5 -
4.將接近飽和的石灰水變成飽和溶液,不可行的方法是( )
A.加入CaO B.加入Ca(OH)2 C.升高溫度 D.加入CaCO3 組卷:401引用:2難度:0.5 -
5.10℃時,將3g甲、乙兩種可溶性固體分別放入盛有10mL水的試管中。兩種物質的溶解情況(見圖Ⅰ),兩種物質的溶解度隨溫度的變化(見圖Ⅱ)。下面對甲、乙兩物質的判斷,不正確的是( )
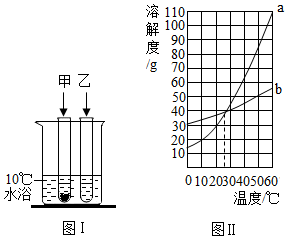
A.10℃時,甲、乙兩物質的溶液都是飽和溶液 B.溫度升高至25℃時,甲、乙兩物質的溶液都是不飽和溶液 C.甲物質對應的溶解度曲線為a D.可用降溫結晶法將甲乙的混合液中的甲分離出來 組卷:490引用:11難度:0.5 -
6.下列是某同學進行過濾操作時的一些做法,其中錯誤的是( )
A.讓濾紙邊緣低于漏斗口 B.直接向漏斗中傾倒待過濾的液體 C.讓漏斗下端管口緊靠燒杯內壁 D.讓漏斗中液面始終低于濾紙邊緣 組卷:2046引用:40難度:0.9
二、綜合應用題
-
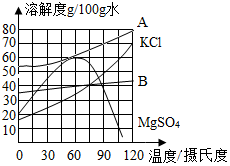 19. NaCl在生產和生活中具有廣泛的用途,是一種重要的資源。通過晾曬海水可以得到粗鹽和母液(又叫苦鹵)。如圖為母液中最主要的四種鹽(NaCl、KCl、MgCl2、MgSO4)的溶解度曲線圖。回答下列問題:
19. NaCl在生產和生活中具有廣泛的用途,是一種重要的資源。通過晾曬海水可以得到粗鹽和母液(又叫苦鹵)。如圖為母液中最主要的四種鹽(NaCl、KCl、MgCl2、MgSO4)的溶解度曲線圖。回答下列問題:
(1)①90℃時,四種鹽中MgCl2的溶解度最大,則表示MgCl2溶解度曲線的是。 (填“A”或“B”) 此時飽和MgCl2溶液的質量分數為(請寫出計算表達式即可)。
②四種鹽中溶解度受溫度變化的影響最小的是。 (填化學式)
(2)60℃時,若母液中的NaCl、KCl、MgCl2、MgSO4都已達到飽和,為了獲得較純凈的MgSO4晶體,可采用的最好方法是。
(3)工業上常通過加入堿溶液與母液中的Mg2+反應來制取Mg(OH)2沉淀。為了探究獲得較高Mg2+沉淀率的反應條件,進行下列對比實驗(每組實驗取250mL母液)。
①本實驗研究了哪些因素對Mg2+的沉淀率的影響實驗序號 反應溫度/℃ 反應時間/min 反應pH值 Mg2+的沉淀率/% a 40 60 10 90.1 b 40 60 12 92.7 c 40 90 12 93.6 d 50 60 12 96.4 e 50 90 12 X ;
②實驗a和b對比,可得到的結論是;
③表格中x的數值可能為(填字母)。
A.95.8 B.92.1 C.97.2 D.93.1組卷:58引用:2難度:0.5 -
20.KMnO4可用作消毒劑、氧化劑、藥物和分析化學試劑等。某小組為探究制備高錳酸鉀的綠色化方案,設計了如圖1所示的實驗流程。
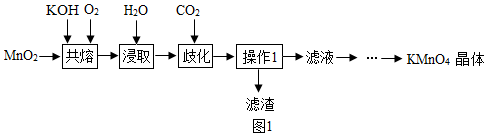
【資料】:①K2MnO4水溶液呈墨綠色,在水及酸性條件下會發生歧化反應,生成KMnO4和MnO2。
②歧化反應的化學方程式是3K2MnO4+2CO2=2KMnO4+MnO2+2K2CO3。
③高錳酸鉀溶液為紫紅色。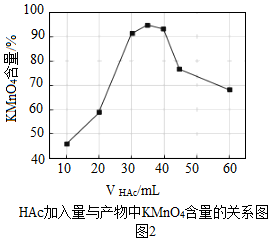
(1)共熔時(加溫加壓),反應生成K2MnO4和H2O,反應的化學方程式是。
(2)判斷歧化時K2MnO4完全反應的方法是:用玻璃棒蘸取溶液點在濾紙上,若觀察到,表示反應已完全。
(3)若在實驗室中完成操作1,需要用到的玻璃儀器有。
(4)在獲得晶體之前要進行烘干操作,烘干時,溫度不宜過高,原因是。
(5)從經濟角度考慮,實驗中可循環使用的物質是(填化學式)。
(6)實驗中,也可以加入醋酸(HAc)進行歧化,圖2是歧化時HAc加入量與產物中KMnO4含量的關系圖。可以發現的規律是:。
(7)實驗室中可用KMnO4制取氧氣,請計算:
①理論上31.6 g高錳酸鉀完全分解可以制得多少克氧氣。
②反應后固體中鉀元素的質量分數(以上都寫出計算過程,計算結果精確到小數點后1位)。組卷:47引用:2難度:0.4


