上海版九年級下冊《5.1 生活中的酸和堿(一)》2024年同步練習卷
發布:2025/7/1 19:0:9
一、選擇題
-
1.學會識圖能發展科學思維。下列圖像與反應過程的變化趨勢對應正確的有( )
序號 ① ② ③ ④ 圖像 
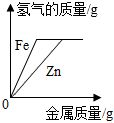


反應過程 KMnO4受熱分解 向含等質量HCl的稀鹽酸中分別加入Zn和Fe至過量 向NaOH溶液中逐滴加入稀鹽酸至過量 木炭在充滿O2的集氣瓶中燃燒 A.1個 B.2個 C.3個 D.4個 組卷:48引用:2難度:0.5 -
2.下列物質中,既屬于鈉鹽,又屬于硝酸鹽的是( )
A.NaNO3 B.AgNO3 C.NaCl D.Na2CO3 組卷:8引用:1難度:0.6 -
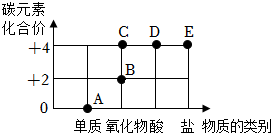 3.元素化合價和物質類別是認識物質的兩個重要維度,構建元素化合價和物質類別的二維圖是學習化學的一種重要方法。如圖是碳元素的“價類二維圖”,下列說法錯誤的是( )
3.元素化合價和物質類別是認識物質的兩個重要維度,構建元素化合價和物質類別的二維圖是學習化學的一種重要方法。如圖是碳元素的“價類二維圖”,下列說法錯誤的是( )A.A點對應的物質一定是金剛石 B.B點對應的物質與C點對應的物質可以相互轉化 C.D點對應的物質很不穩定,容易分解 D.E點對應的物質可能是K2CO3 組卷:181引用:8難度:0.5 -
4.芯片是電腦智能家電的核心部件,它是以高純度的單質硅(Si)為材料制成的。硅及其氧化物能發生如下反應:①Si+O2
SiO2;②SiO2+Na2CO3△Na2SiO3+CO2↑;③SiO2+2C高溫Si+2CO↑;④Si+2NaOH+H2O高溫Na2SiO3+2H2↑,下列說法不正確的是( )△A.Na2SiO3屬于鹽 B.硅由硅分子構成 C.Na2SiO3和SiO2中硅元素都顯+4價 D.Si和SiO2在一定條件下可以相互轉化 組卷:10引用:2難度:0.8 -
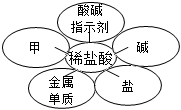 5.某學習小組根據所學知識利用花瓣歸納了稀鹽酸的五條化學性質(如圖所示)。每片花瓣表示一類物質,且稀鹽酸均能與花瓣代表的物質發生反應,下列說法中不正確的是( )
5.某學習小組根據所學知識利用花瓣歸納了稀鹽酸的五條化學性質(如圖所示)。每片花瓣表示一類物質,且稀鹽酸均能與花瓣代表的物質發生反應,下列說法中不正確的是( )A.甲與稀鹽酸反應后可能得到藍色溶液 B.能觀察到氣泡的反應最多有兩種 C.將燒堿固體加入一定量稀鹽酸的過程中,溶液的pH減小 D.向稀鹽酸中滴加紫色石蕊試液,溶液變紅 組卷:76引用:1難度:0.5 -
6.下列化學用語正確的是( )
A.氫單質的化學式H B.氦氣的化學式He C.鎂的元素符號mg D.三氧化二鐵的化學式2Fe3O 組卷:6引用:2難度:0.9 -
7.下列物質屬于難溶性鹽的是( )
A.CaCO3 B.CuSO4 C.KNO3 D.NaCl 組卷:3引用:2難度:0.6 -
8.下列物質屬于鹽的是( )
A.純堿 B.燒堿 C.鹽酸 D.熟石灰 組卷:34引用:16難度:0.7 -
9.某同學在學中構建了如圖的“氮及其化合物的價、類二維關系圖”,下列敘述正確的是( )
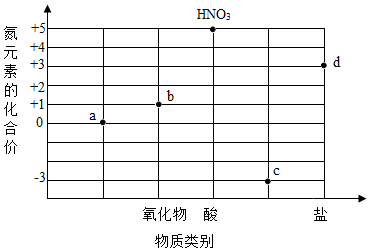
A.最常見的單質a是由原子構成的 B.物質b為空氣中的主要成分 C.物質c可能遇酚酞溶液變紅 D.物質d的化學式可以是NaNO3 組卷:46引用:2難度:0.5 -
10.下列有關化學知識的廣泛應用中不正確的是( )
A.熟石灰可用于改良酸性土壤 B.利用化學知識研制新材料說明化學可以創造新物質,也可以改變元素種類 C.開發利用生物柴油、氫能等新能源,可以緩解能源危機 D.自然界的水經沉淀、過濾、吸附的凈化處理后,不能降低水的硬度 組卷:16引用:2難度:0.5 -
11.推理是學習化學常用的思維方法,下列推理正確的是( )
A.在化學變化中原子不能再分,所以在化學變化中離子也不能再分 B.洗滌劑除油污的原理是乳化,所以氫氧化鈉除油污的原理也是乳化 C.CO2使飽和石灰水變渾濁是化學變化,所以升溫使飽和石灰水變渾濁也是化學變化 D.化合物是由不同種元素組成的物質,所以由同種元素組成的物質一定不是化合物 組卷:806引用:12難度:0.5 -
12.洗發產品生含有的枸櫞酸(C6H8O7)能使頭發柔順有彈性且氣味清香。下列關于枸櫞酸的說法正確的是( )
A.枸櫞酸是由6個碳原子、8個氫原子和7個氧原子構成的 B.枸櫞酸的相對分子質量為192g C.枸櫞酸中氧元素的質量分數最大 D.枸櫞酸中碳、氫、氧三種元素的質量比為6:8:7 組卷:11引用:1難度:0.5 -
13.取四種植物的花瓣,分別放在研缽中,加入酒精研磨。各取少許,用稀酸或稀堿進行檢驗,結果如下表所示。不能做酸堿指示劑的花汁有( )
花的種類 花汁在酒精中的顏色 花汁在酸溶液中的顏色 花汁在堿溶液中的顏色 大紅花 粉紅色 橙色 綠色 玫瑰 粉紅色 粉紅色 綠色 萬壽菊 黃色 黃色 黃色 雛菊 無色 無色 黃色 A.萬壽菊 B.大紅花 C.玫瑰 D.雛菊 組卷:236引用:3難度:0.5 -
14.下列溶液中,滴入石蕊試液,石蕊變紅的是( )
A.食醋 B.石灰水 C.蒸餾水 D.氫氧化鈉溶液 組卷:69引用:1難度:0.6
二、填空題
-
15.下表是某地市場上銷售的一種“加碘鹽”包裝袋上的部分文字說明.請根據此表,結合初中學過的化學知識,回答下列問題:
(1)碘酸鉀屬于哪類化合物?配料表 精制海鹽、碘酸鉀(KIO2) 含碘量 20~40mg/kg 儲藏方法 密封避光、防潮 食用方法 烹調時待食物熟后加入碘鹽 (填酸、堿、鹽或氧化物)
(2)根據含碘鹽的食用方法,可推測碘酸鉀的化學性質:碘酸鉀在受熱時.組卷:13引用:12難度:0.9 -
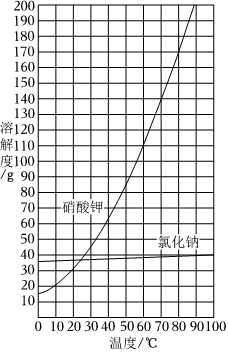 16.如圖,為KNO3和NaCl的溶解度曲線,回答下列問題:
16.如圖,為KNO3和NaCl的溶解度曲線,回答下列問題:
(1)60℃時,KNO3的溶解度為。
(2)40℃時,現有KNO3和NaCl兩種飽和溶液,下列說法正確的是。
A.等質量的KNO3飽和溶液中水的質量小于NaCl飽和溶液中水的質量
B.降溫到10℃時,析出的KNO3晶體質量比析出的NaCl晶體質量大
C.升溫至60℃時,KNO3溶液的質量分數等于NaCl溶液的質量分數
(3)要將硝酸鉀從其飽和溶液中全部結晶出來,應采用的方法是(選填“降溫結晶”或“蒸發結晶”)。組卷:6引用:2難度:0.5 -
17.用化學用語回答問題:
(1)醫療酒精中的溶質是。
(2)用于改良酸性土壤的堿是。
(3)生理鹽水中的鹽的化學式。組卷:8引用:2難度:0.6 -
18.同學們在學習酸堿的化學性質時構建了如圖知識網絡,A、B、C、D是不同類別的物質,“﹣”表示物質在一定條件下可以發生化學反應。請回答下列問題:

(1)反應①的實驗現象為;
(2)反應④可用于工業上制燒堿,則其化學方程式為,基本反應類型為。組卷:96引用:2難度:0.5 -
19.常見的不溶性堿有
(色)、(色)、(色),常見的可溶性堿有.組卷:16引用:3難度:0.9 -
20.藥品分類存放是實驗室管理的基本要求,某校實驗室的藥品柜里已存放的部分藥品如下:
(1)若要在每個柜子門上貼上物質類別的標簽,則③號柜的標簽上應寫藥品柜編號 ① ② ③ ④ ⑤ 藥品 氫氧化鈉
氫氧化鈣鹽酸
硫酸二氧化錳
氧化銅氯化鈉
硫酸銅鋅粒
銅片。
(2)上述柜子中的有些物質間能發生置換反應,請從柜中選擇兩種物質,寫出它們之間發生的置換反應的化學方程式。組卷:76引用:4難度:0.7 -
21.用化學符號表示:
2個氫原子,5個氫氧根離子,
三氧化二鐵的化學式,4個二氧化碳分子,
1個水分子,+6價硫元素的氧化物的化學式。組卷:3引用:2難度:0.7 -
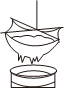 22.豆腐是我國的傳統食物之一。從大豆到豆腐需經歷磨漿、凝固等過程。
22.豆腐是我國的傳統食物之一。從大豆到豆腐需經歷磨漿、凝固等過程。
(1)如圖所示,將大豆研磨后倒入紗布,豆渣留在紗布上,豆乳流入下方容器。該過程相當于物質分離方法中的。
(2)豆乳凝固過程中需要加入硫酸鈣(CaSO4)等凝固劑。按物質的組成分類,CaSO4屬于純凈物中的。組卷:11引用:0難度:0.7 -
23.閱讀下段文字回答問題:①氫氧化鈉又叫火堿、燒堿、苛性鈉. ②氫氧化鈉固體極易溶于水,溶解時放出大量的熱③暴露在空氣中氫氧化鈉易吸收空氣中的水而潮解 ④氫氧化鈉還能與空氣中的二氧化碳反應生成碳酸鈉 ⑤氫氧化鈉還能與指示劑、酸、氯化鐵等物質反應 ⑥氫氧化鈉是一種重要化工原料,用途廣泛 ⑦純凈的氫氧化鈉是一種白色固體,它的水溶液有澀味和滑膩感.
(1)用序號回答:短文中敘述的物理性質有.短文中敘述的化學性質有.
(2)氫氧化鈉應保存,其原因是.組卷:40引用:2難度:0.9 -
24.現有:A.熟石灰 B.碳酸鋇 C.苛性鈉 D.氧化鐵 E.碳酸鉀 F.硫酸 G.氧化銅 H.鹽酸 八種物質,選用其中的物質,用化學式 表示,寫在下列相應的橫線上:
(1)屬于紅色氧化物的是; (2)屬于不揮發性酸的是;
(3)屬于易溶性堿的是; (4)屬于難溶性鹽的是.組卷:49引用:4難度:0.9 -
25.2011年3月17,因日本福島第一核電站發生核輻射泄漏,我國香港和內地部分民眾聽信謠言,認為碘鹽可以防護核輻射,出現搶購碘鹽的瘋狂熱潮.碘鹽中添加一定量的碘酸鉀(KIO3 ),不同于藥物碘片,而碘片中主要成分為碘化鉀,則碘酸鉀和碘化鉀都屬于化合物中的
,其中碘元素化合價分別為、.組卷:29引用:4難度:0.7 -
26.按要求完成下列各題
(1)金屬是我們生產過程中應用廣泛的材料,人類較早使用的金屬是(“銅”或“鐵”)目前世界上產量最高的金屬是,銅導線是利用了銅的性質。
(2)醫用酒精中酒精占75%是比(“質量”或“體積”);
(3)爐具去污劑中所含主要物質是(“鹽酸”或“氫氧化鈉”)
(4)在常見去污劑中,依據乳化原理去油污的是(汽油”或“洗滌劑)
(5)常用于食品干燥的生石灰的化學式為,冰箱除臭可用的一種碳單質是。組卷:37引用:2難度:0.6 -
27.某化學活動小組以“酸堿鹽的性質”為主題,進行探究學習,請你作為該小組成員來解決下列問題:
(1)小剛同學說:“酸溶液呈酸性,堿溶液呈堿性,則鹽溶液一定呈中性.”你認為這種推理(填“正確”或“不正確”),你的例證是.
(2)小麗同學從某一欠收農田里取回一份土壤樣品,請你用兩種不同的方法幫小麗測出該土壤樣品浸出液的酸堿性(只寫出所用試劑的名稱即可):
①;②.
如果檢測的結果呈酸性,那么要改良此土壤,應該向農田里施加.
(3)請你設計一個實驗,能通過清晰可見的現象,除去氯化鈣溶液中的少量稀鹽酸.你的實驗方案是(寫出實驗操作、現象和結論).組卷:104引用:13難度:0.5
三、多選題
-
28.下列四個實驗方案中設計不合理的是( )
選項 實驗目的 實驗方案 A 鑒別尿素和氯化鈉 分別加熟石灰粉末研磨,聞氣味 B 鑒別硝酸銨和氯化鈉 分別加適量水,用手觸摸容器壁 C 鑒別硫酸銅溶液和稀鹽酸 分別觀察溶液顏色 D 鑒別燒堿溶液和石灰水 分別滴加酚酞試液,觀察顏色變化 A.A B.B C.C D.D 組卷:41引用:1難度:0.5


